当前位置:首页 > 专题 > 分子生物学
当前位置:首页 > 专题 > 分子生物学
鼻内滴注法是一种直接的AAV感染法,操作简单且对设备要求低,对新手实验员也同样适用。缺点是AAV颗粒容易沉积在上呼吸道(鼻道、鼻窦和咽)和胃肠道,如果需要有效地感染到下呼吸道,则可能需要更大剂量的AAV才能实现。
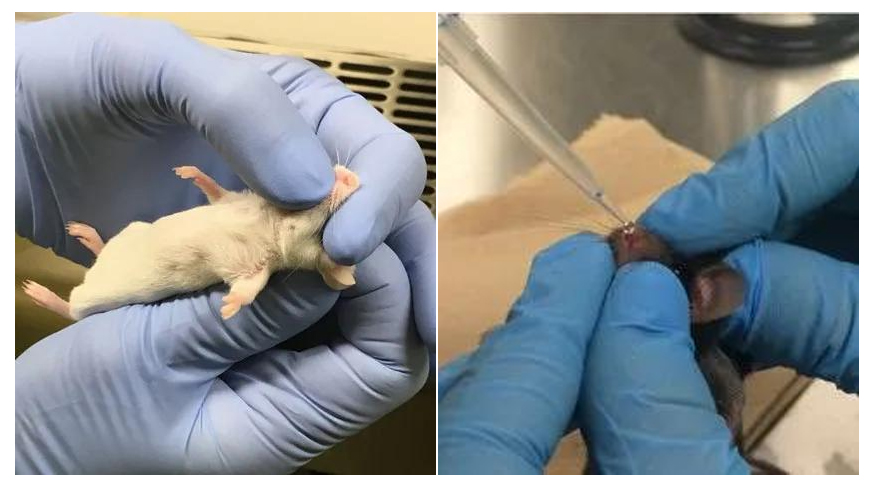
(1)腹腔注射氯胺酮和甲苯噻嗪将小鼠麻醉;
注意:为了保持小鼠稳定的呼吸频率,不应过度麻醉。
(2)甲按图1所示两种方法将小鼠控制好,防止其用嘴呼吸;
(3)乙缓慢滴一滴AAV悬液于小鼠鼻孔内壁,待液体被吸入后再滴下一滴,重复此操作至40μL AAV悬液全部滴完;
(4)使小鼠保持上述姿势约30~60s,以便AAV悬液充分进入下呼吸道;
(5)待小鼠在笼中恢复10min后,重复上述操作,再次给药40μL(每只小鼠共给药80μL);
(6)将小鼠放回笼中直至完全清醒。
口腔气管插管术能够将病毒载体直接灌输入肺中,却没有外科手术的风险,并且避免了上呼吸道的病毒颗粒的损失。由于几乎所有AAV病毒颗粒都会到达肺内,所以要严格控制AAV的使用量。同时,与鼻内滴注法相比,口腔气管插管术需要一些特殊设备,操作起来也稍有难度。
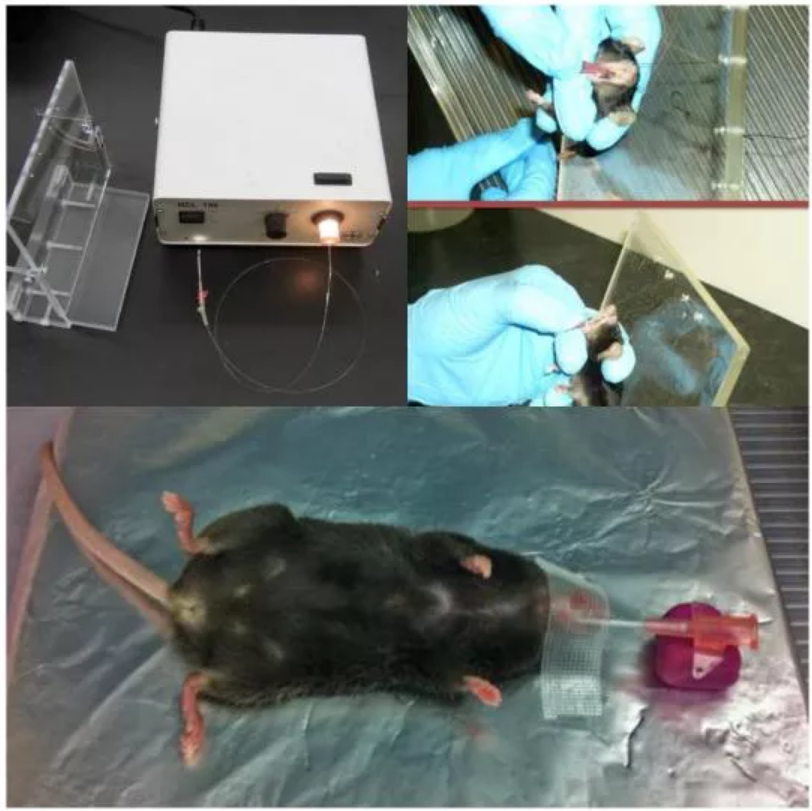
(1)腹腔注射氯胺酮和甲苯噻嗪将小鼠麻醉;
注意:动物必须处于足够深的麻醉状态以防止运动或对载体的反应而打喷嚏或咳嗽;
(2)将小鼠放在垂直支架上,将门牙环置于小鼠上门牙上,让老鼠的腹部面向自己;
(3)轻轻地把小鼠舌头拉出来,并用拇指和食指按住,中指放在小鼠颈部和塑料支架之间;
(4)用食指、拇指在小鼠舌上牵引令其嘴张开,使插管路径伸直,并用中指在颈后调整头部角度;
(5)利用光纤作为光源和引导者,推动它通过可视声带(如果看不到声带,用中指作支撑,轻轻用力拉舌);
(6)光纤插入后,同时将导管向前推进约5mm,然后勿移动导管,取出光纤;
(7)使小鼠平躺,用胶带将导管固定在小鼠嘴部防止其移动,另一端用橡皮泥支撑;
(8)用注射器通过导管输入80μL AAV; 注意:在抽取80μL载体之前,吸取约100μL的空气至移液管尖,以防止载体的丢失,并促进载体深入肺部;
(9)等待5min,使AAV充分进入下呼吸道;
(10)把导管移出,将小鼠轻轻从工作台拿下,并将头部和胸部用折叠的纸巾小幅度垫高,以保证小鼠顺畅的呼吸;
(11)将小鼠放回笼中直至完全清醒。
与鼻内滴注相比,气管内注射能够提高AAV进入肺部的效率;与口腔气管插管法相比,设备更简单,操作更容易。然而,气管内注射具有极高的外科手术风险,包括出血、切口开裂、感染以及较长的恢复期等。不仅如此,由于小鼠气管窄小,很容易出现操作失误,将AAV注射到气管周围组织或食管中去。
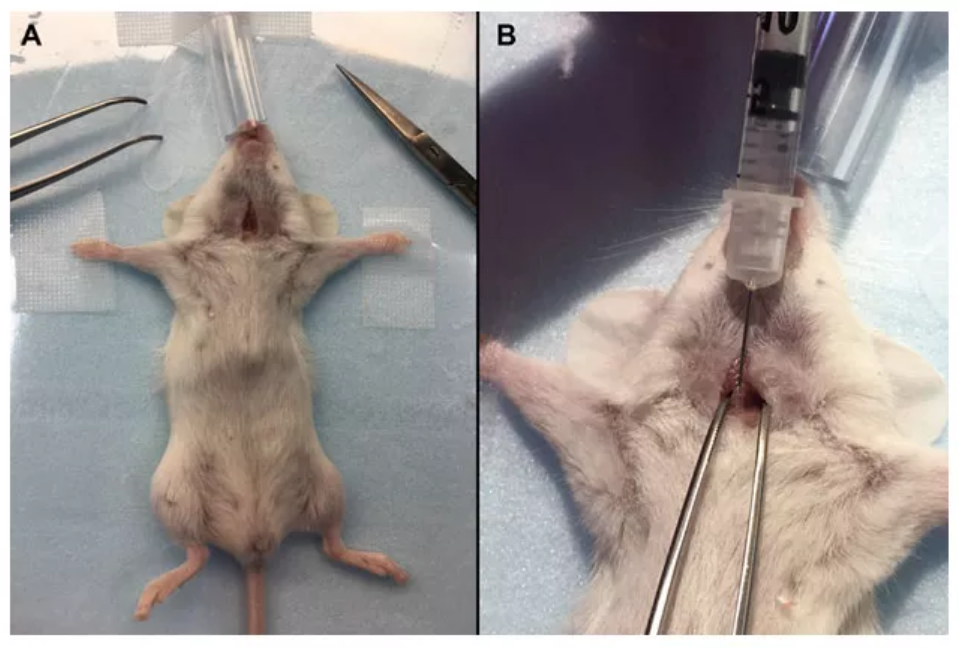
(1)腹腔注射氯胺酮和甲苯噻嗪将小鼠麻醉;
(2)将小鼠以背卧姿势固定在啮齿动物工作台上,并将其前爪伸直固定;
(3)剃除颈部部分区域的鼠毛,并用碘伏做消毒处理;
(4)用手术剪刀在颈部做一个5~7mm的小切口;
(5)手握镊子固定住小鼠气管,另一只手握住注射器,使注射器针头斜面朝上,与气管成45°。
注意:一旦针头插入,轻轻地将针头向外移动,远离小鼠身体,确定针头是否正确地插入气管。
(6)将40~80μL 的AAV缓慢注入气管,等待5s后慢慢取出针管;
(7)缝合伤口,将小鼠放回笼中恢复,直到完全清醒。
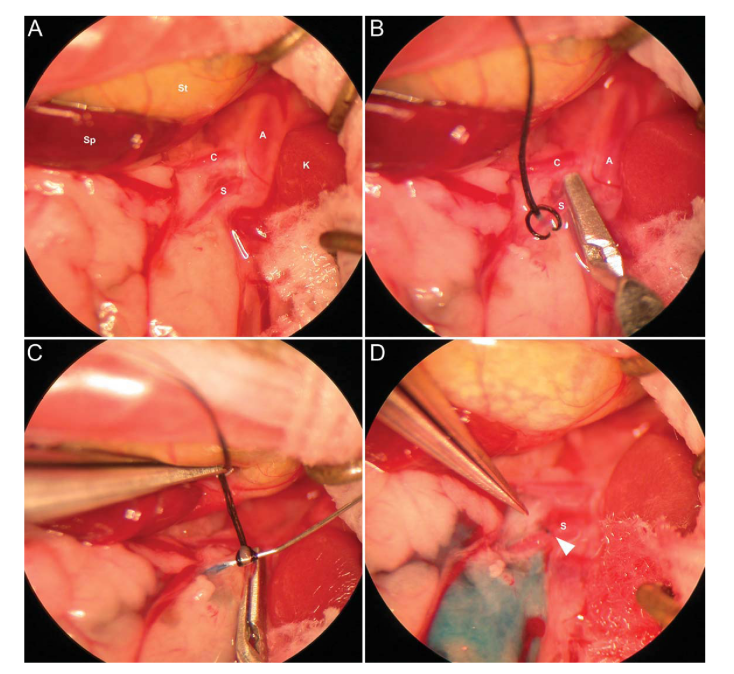
经输尿管肾盂逆行注射后,基因表达分布在肾脏管道系统,可以克服肾小球屏障限制,但注射较难,技术挑战性较大,可根据具体实验目的和实际情况选择合适的注射方式。下面来分享一下经输尿管肾盂逆行注射的操作手法:
① 对C57BL/6 小鼠(4-6 周龄,15-20g)进行麻醉手术,并使小鼠呈仰卧姿势于操作台上;
② 在小鼠左腹部做一个切口并轻轻剖开,找到输尿管远端和肾动脉并用显微止血夹夹住;
③ 用 30G注射针刺破输尿管,将注射针贴合于管壁并固定到位,使用 6-0缝线缝合以防液体泄漏;
④ 将尿液轻轻吸出,将注射器替换为另一个含有约 50ul液体(含有 5*10E10个病毒颗粒基因组拷贝数或PBS)的注射器,并缓慢地将液体逆行注入输尿管;
⑤ 将注射针撤出,并在注射部位的近端放置一个显微止血夹以防液体泄漏;
⑥ 5min后,移去输尿管远端、近端及肾动脉上的显微止血夹,用6-0缝线将切口分两层缝合。
经肾实质肾盂注射后,基因表达分布在皮质和髓质的肾小管上皮细胞中,主要是集合管细胞。此方法是一种新的注射方式,操作简单,基因表达稳定。下面分享一下经肾实质肾盂注射的操作方式供参考:
① 对C57BL/6 小鼠(4-6 周龄,15-20g)进行麻醉手术,并使小鼠呈仰卧姿势于操作台上;
② 对小鼠左腹进行剃毛处理,切开一个2cm的切口暴露左肾和输尿管,并将周围器官和脂肪轻轻分开;
③ 用显微止血夹夹住输尿管上段以阻止病毒原液下流至膀胱;
④ 用30G注射针刺入左肾中极的肾盂(注意注射针头不应刺穿肾盂),将50μL液体(含5*10E10个病毒颗粒基因组拷贝数或PBS)注入肾盂;
注:注射针刺入肾盂而不刺穿肾盂的关键在于注意比对穿刺针和小鼠肾脏,并且在注射针上做好标记;
⑤ 5min后移去显微止血夹,将切口分两层缝合。
哺乳动物的肾脏具有严格的过滤功能,排斥大于50kDa的蛋白质,此外,肾小球内的足细胞形成直径仅为10nm的狭缝横膈膜,传统的AAV载体全身给药难以在肾脏达到足够的表达水平,即便是高剂量给药也会导致AAV集中在肝脏等肾外器官中。为了提高病毒载体对肾脏的转导并降低病毒载体对肾外器官的转导效率,除了全身给药方式外,近年来,科学家陆续开发了肾脏局部给药途径包括肾动脉注射、肾静脉注射、经肾实质注射、经输尿管逆行给药和经肾实质肾盂注射等(图1)。
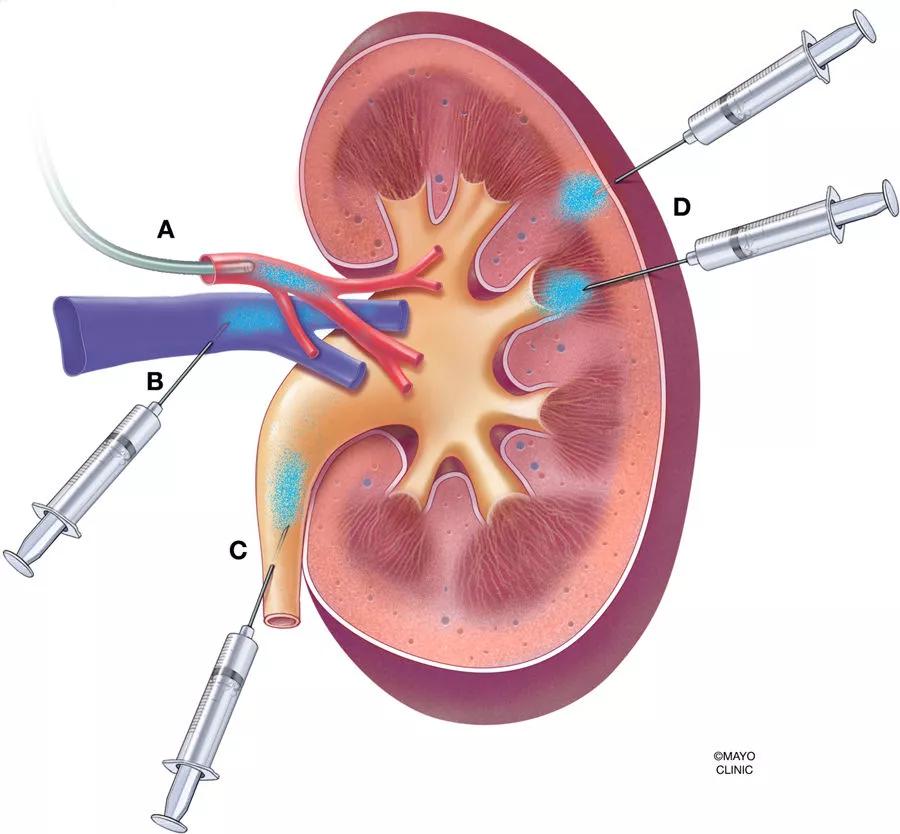
携带目的基因的病毒载体通过肾静脉注射后,基因可在皮质和髓质中表达,主要在肾小球和近端小管中表达,但难以突破肾小球屏障,效率较低。下面就来分享一下肾静脉注射的操作方式:
① 对C57BL/6 小鼠(4-6 周龄,15-20g)进行麻醉手术,并使小鼠呈仰卧姿势于操作台上;
② 给小鼠左腹剃毛,在小鼠左腹部做一个切口,暴露左肾及肾蒂,并将肾静脉从肾蒂中游离;
③ 用显微止血夹夹住肾静脉远端以阻止病毒原液流出肾脏;
④ 用30G注射针刺入左肾静脉近端,将50μl液体(含有 5*10E10个病毒颗粒基因组拷贝数或 PBS)注入肾静脉;
⑤ 5min后,拔出注射针,移去显微止血夹并压迫止血片刻,将切口分两层缝合。
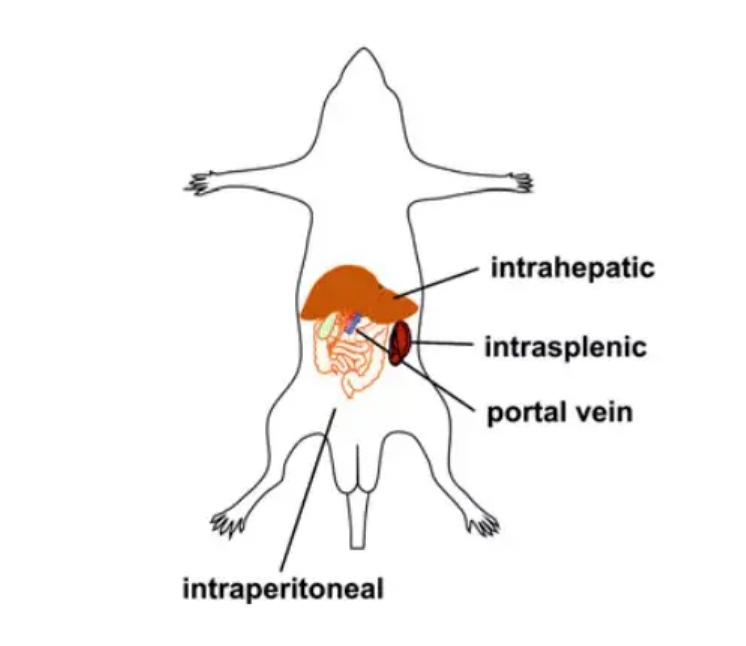
AAV在肝脏中的注射方式分为直接传送和外周传送两种(下表所示),直接传送靶向性高但侵入性强且对实验技能要求高,外周传送操作简单但靶向性稍差,操作者可根据实验目的选择合适的注射方式。
|
注射 |
覆盖 | 优点 | 缺点 |
|---|---|---|---|
|
直接 传送 |
肝叶注射、门静脉注射、脾包膜注射;肝动脉注射(大动物与人); | 克服了转导效率低的问题,靶向性高,所需病毒量少; | 侵入性强,风险大,实验操作技能要求高; |
|
外周 传送 |
腹腔注射和静脉注射(尾静脉注射和眶后静脉窦注射等); | 操作简单,无须手术或麻醉; | 靶向性较直接传送稍差,可能需要较多的注射体积; |
01 通过腹腔注射麻醉剂将成年小鼠麻醉,对小鼠腹部局部区域做去毛及消毒处理;
02 在距剑突软骨下方2-3mm处,做一个2-3cm的中线切口。
03 暴露门静脉,使用30G针头在1min内均匀缓慢注射0.2 ml病毒悬液。
注:门静脉是一种相对较大的静脉,提起肝前叶一般即可看到门静脉。在手术过程中,用浸泡在生理盐水中的无菌纱布覆盖肠道,保持肠道湿润。
04 注射后保持针位约10-20秒。取出针后,做好防出血处理;
05 缝合腹部,将小鼠放置于加热灯下,直至恢复意识。然后将其放回笼子单独饲养,直到伤口完全愈合。
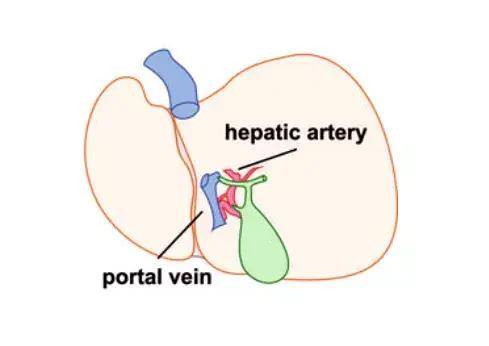
肝内注射可以克服转导效率低的问题,靶向性高,所需病毒量少;缺点则是侵入性强,风险大,实验操作技能要求高,研究者可根据实验目的选择合适的操作方式。下图为小鼠肝脏AAV给药途径示意图:
01 通过腹腔注射麻醉剂将成年小鼠麻醉,对小鼠腹部局部区域做去毛及消毒处理;
02 在距剑突软骨下方2-3mm,做一个2-3cm的中线切口,以露出肝脏。
03 用固定在结核菌素注射器上的30G针头将病毒悬液缓慢注入肝实质中。
注:在注射过程中通过手术立体镜监测注射部位,确保无出血或外渗。如果出现上述任何一种情况,需取出针头,轻轻按压止血,然后选择一个新的部位进行注射。
04 取出针,用无菌纱布轻轻按压止血。
05 再选择其他部位进行注射。
06 缝合腹部,将小鼠放置于加热灯下,直至恢复意识。然后将其放回笼子单独饲养,直到伤口完全愈合。
注:一只成年小鼠一次可选择4 ~ 5个不同的注射位点(40 ~ 50μl/site),总剂量可达200μl。
肝脏对全身应用AAV有较高的亲和性,使用外周传递方式如静脉注射,配合AAV8等肝脏嗜性较强的血清型以及TBG等肝脏特异性启动子也可以较好的将目的基因递送到肝脏进行表达,操作方式简单且对动物侵入性伤害较小。
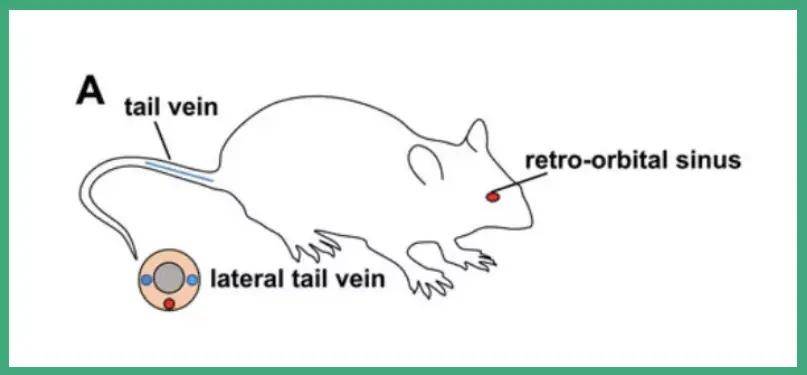
1. 尾静脉注射
将小鼠放在标准限制器中,使注射器能够完全接触到整个尾巴长度。
将一根30G的针头固定在1cc结核菌素注射器上,尽可能远的插入尾部侧面静脉。选择一个远端部位,如果第一次注射失败,可以选择另一个更近端的注射部位。
注:a:小鼠尾巴上较容易接触到的静脉位于尾巴的侧面,且侧静脉非常浅,无需进针很深;小鼠尾部背面的静脉很难常规注射;尾部腹面的血管是动脉,不可注射。b:注射前用温水轻轻地加热尾巴,可以使血管得到一定程度的舒张,便于注射。
注射完成后取下针头,轻轻按压止血,然后立即将小鼠放回笼中。
注:使用此方法注射成年小鼠,病毒用量控制在300 -400μl较佳。
2. 新生小鼠静脉注射
需两个人配合完成,一人固定,一人注射;
注射前将小鼠置于干毛巾上,减少活动及损伤;
一人轻轻固定小鼠,使侧面朝上,暴露眼睛至颈部的颞浅静脉,置于放大镜下;
另一人沿着自头至颈的方向将30G的注射针头插入静脉旁的皮下,慢慢推进静脉(新生鼠皮肤呈现半透明,较易观察);
慢慢注射病毒悬液;(如果注射成功,注射部位远端静脉会呈白色,如果未成功,皮下注射10μl即可看到明显的隆起)
注射完成后,取下针头,轻轻按压静脉,通常2-3分钟会停止出血;
将新生鼠在加热灯下照射后,放回母鼠身边;
如果注射不成功,让小鼠恢复5-10分钟,然后在另一侧尝试第二次注射;
注:使用此方法注射新生小鼠,病毒用量控制在100μl以内较佳。
视网膜下注射(SR)是将药物注入光感受器细胞和RPE之间的视网膜下腔,这需要使视网膜的神经上皮层与色素上皮层分离,形成视网膜下腔。SR是将基因直接递送至RPE细胞或光感受器细胞的有效方法,但此方法侵入性较大,容易使视网膜脱离,可能会引起胶质细胞增生、光感受器退化及视力功能损伤等,并且药物扩散有限只能实现局部转导。
视网膜下腔注射,主要转染视网膜色素上皮细胞和光感受器细胞,不会触发体液免疫反应,对另一只眼再次视网膜下注射也无影响。
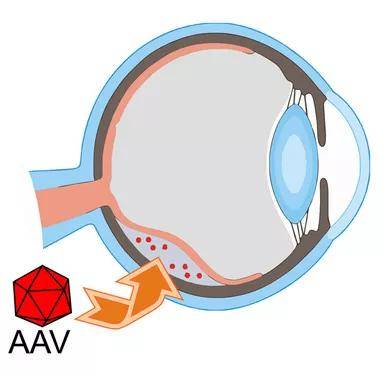
1、麻醉:对于成年小鼠,异氟醚吸入麻醉或联合使用氯胺酮(100mg/ml)和赛拉嗪(20mg/ml)按照0.1ml/10g腹腔注射; 对于围产期小鼠,异氟烷吸入麻醉或低温麻醉;
2、使用Vannas直剪沿着闭合的眼睑裂开大约1.5 mm的切口;注意切口不要太大;
3、用弯曲的敷料钳将眼皮分开,以支撑眼睛,并在眼睛下方稍微捏紧眼皮,将其拿起以供注射;
4、在眼球中纬线或中纬线后方做一个小的巩膜切口,切口够注射针尖端通过即可;
5、小心地将注射针插入切口部位,并平行于眼外壁进入视网膜下腔;
6、开始注射,如果正确注射至视网膜下腔,能感受到适度的阻力;缓慢出针,可将针头固定15s,避免注射病毒回流到切口位置;
7、使用弯曲的敷料钳轻轻地将眼睛推回眼眶;将适量0.25%布比卡因,滴在注射部位;
8、小鼠苏醒后置于加热垫上,整个注射过程控制在5min内完成;
9、小鼠恢复活动能力后放回鼠笼。
玻璃体腔注射(IVT)是将药物直接注入眼球玻璃体腔内,侵袭性较小、术后并发症较少,但由于内界膜ILM的存在,大多数AAV血清型无法传递至RGCs之外的细胞内。
玻璃体腔注射较适用于视网膜神经节或Müller神经胶质细胞的靶向。此种注射方法会产生针对AAV衣壳蛋白的体液免疫反应,这种反应可阻碍再次注射时AAV的表达,如果两只眼都需要连续治疗的话,需要避免使用这种注射方式。
1、麻醉:4.3%水合氯醛 0.01ml/g ;
2、散瞳:建议双眼散瞳,以防一眼出现意外时可以迅速换眼;
3、甲基纤维素保持眼表湿润;
4、抗生素眼药水、表麻药术前滴眼;
5、调整小鼠头位,让小鼠眼球保持角膜缘水平位;
6、注射位置:理论上是角膜缘后1mm,也有选择在颞侧进行,注意避开血管。白鼠还可以看见视网膜血管,需避开;
7、注射切口:推荐使用ALCON的10-0针做切口,非常整齐,33G的针进去水密非常好。也可以用破囊针。切口越整齐,跟针越匹配,越不易渗漏;
8、注射进针:针尖垂直进入,随后倾斜。这一步非常关键,小鼠眼球小,晶体球形,倾斜角度小了会损伤晶体,大了会扎上视网膜,出血;
9、注射:缓慢推注,无阻力。迅速推注的话取材时会发现视网膜散在出血点,可能干扰试验结果。推针以后留针0.5-1min,迅速出针。
脑定位注射,相比其他注射方式靶向性强,注射病毒体积小,但是侵入性也强,且对操作者具有很高的要求。在立体定位手术时,颅骨上常用的注射参照点是前囱,也就是中矢状冠状缝的交叉点。具体的注射部位,可依据研究的需要而确定。
1、安装定位仪:在生物安全柜中安装立体定位框架和工具。
2、准备并吸取病毒悬液:在喷嘴出安装超微量注射器,把针尖浸在准备好的AAV病毒悬液中,并使用“快速反向”功能吸取。
3、排除空气:使用“快速正向”功能检查泡沫,直到在针头处出现一滴液体。用浸泡在0.1M NaOH溶液中的棉花轻轻拭去针尖的液滴。
4、麻醉大鼠:选取250g左右的大鼠,通过25G 1毫升注射器注射甲苯噻嗪(10mg/kg)和氯胺酮(100mg/kg)。
5、固定大鼠:首先将大鼠的下切牙固定在齿棒上,然后用耳棒通过大鼠的外耳道进行固定,并固定头部。检查颅骨是否是水平的,并确保两个眼睛在同一水平线上。在每只眼睛中滴入一滴聚丙烯酸,以防麻醉造成眼睛干燥。调整光源对准大鼠的头部,剃去头部的毛并用酒精消毒清洁。
6、切口并暴露前囱点:用刀片在头皮上前后轴切口,并用钳子保持刀口开放状态,用棉球吸去血。去除骨膜以便看到前囱。
7、暴露λ点:调整齿夹的垂直位置,使得前囱点和λ点的高度一致,如果λ点的位置难以看到,让切口处干燥5-10min后再寻找。
8、确定前囱点的AP和ML坐标和目标注射点的距离:将针垂直于前囱点,并记录AP和ML坐标的数值。参考大鼠脑图谱的标记的目标注射部位的AP和ML值,计算前囱点与目标注射部位的AP和ML坐标,并做标记。
9、确定前囱点的DV坐标和目标注射点的距离:用钻头在颅骨上打洞,注意不要损伤硬脑膜。把针尖置于硬脑膜的表面并测量出前囱点DV的坐标。计算目标注射部位的DV坐标。
10、注射AAV:缓慢垂直移动注射器针尖到达目标注射部位,慢慢地将针插入并静置5min。然后,以0.2 μl/min的速度,将2μL的病毒悬液注射入脑。结束后,需要静置5min再将注射器缓慢移出。
11、缝合并做标记:缝合头皮,并做耳标。
12、大鼠术后的护理:将大鼠单独放在一个干净的笼子里,直到醒来。第一天需要让大鼠在独立的通风笼中度过。
13、处理针头和手术材料:先用0.1 M NaOH 或10%氯漂白剂清洗手术工具,并用蒸馏水冲洗,最后用酒精冲洗。

与系统注射和实质内注射相比,鞘内给药是一种具有较低剂量要求的微创替代方法。
1、使用毛巾覆盖在小鼠头部和背部,露出髂嵴以下的腰部区域;用非惯用手的拇指和食指抓住鼠的髂骨(髋骨),手的顶部轻轻放在小鼠身体和头部上,使其保持平静。
注:在髂骨上的握力应该足够强,以固定小鼠的腿部活动,并使腿部向外和向下伸展。
2、使用惯用手食指从腰椎到骶部沿脊柱轻轻按压,同时使用非惯用手轻轻上拉小鼠,以打开椎节之间的空间,方便进针。
3、将1 ¼”号针的斜面指向小鼠头部,然后将针以70°角插入脊柱中线的腰椎处,当感觉针碰到骨头时,将针的角度调整到30°夹角,并将针插入椎节之间。
注:需多次尝试找到合适的进入点,针头进入脊柱后推针没有阻力,尾巴或后腿的反射性弹跳出现时,说明已正确入针。
4、轻轻压下注射器的活塞,将5-10μL的AAV病毒悬液注射至蛛网膜下腔。
注:注射时间控制在10-30s较好,速度太快会导致小鼠后腿抽筋,该现象会在60s内消失。
5、注射后,将针180°旋转1-2次,然后将针从脊柱中取出。
6、小鼠放回笼子观察,确认恢复正常运动功能。
注:此法适用于成年小鼠或大鼠。
肠组织常见的注射方式有尾静脉注射、腹腔注射、口服、灌肠和肠系膜上动脉(SMA)注射等。其中尾静脉注射和腹腔注射作为系统性给药方式,虽然操作简单,损伤性小,但是注射量较大,特异性不强。口服和灌肠,都属于腔内给药,主要是黏膜的转导,由于胃酸及肠蛋白水解酶等的中和作用,其转导效率并不高,但操作简单。
(1)小鼠禁食过夜,并预先用NAC和毛果芸香碱处理以促进肠道隐窝黏液排出。
(2)使用异氟醚将小鼠麻醉。
(3)在不使用镇静剂的状态下,用1英寸不锈钢的直圆针头直肠注射300ul 20mM的NAC清洗结肠30min。
(4)再次麻醉小鼠,通过灌肠给予小鼠5*10E10vg,600uL体积量的AAV。
注:可通过直肠注射亚甲基蓝观察液体到达盲肠的预实验,确定合适的灌肠液体积。
肠系膜动脉(SMA)注射效果较好,但对实验条件和操作手法要求较高,对小鼠伤害性也较大。
(1)将小鼠以右侧卧位固定在手术板上,保持四肢松弛,放入含2-4.5% O2的异氟醚诱导室进行麻醉。小鼠深度麻醉后,将其放在手术台上,对小鼠手术区域做去毛及消毒处理。
注:为保持小鼠体温,可在手术板下放置加热垫。整个手术过程在手术显微镜下放大5-40倍进行操作。
(2)手术开始前,皮下注射丁丙诺啡进行手术镇痛;沿左腋线最后一个肋间隙和肋下区域注射布比卡因进行局部镇痛。
(3)沿着腋线和侧腹,在脾脏区域的左侧皮肤上开一个1-2 cm的切口,切开腹外斜肌,使用微型牵引器将皮肤和腹壁固定,并用温盐水纱布覆盖小肠防止缩回,暴露SMA。
(4)在放大20倍的情况下,将SMA轻轻地从腹膜后剥离,在SMA的近端接头周围放置一个小的稳定接头连接注射针,使用微血管夹暂时切断腹主动脉的血液供应。
(5)将定制33号1/2”针头连接到250μl汉密尔顿TLL气密性进样针注射器上,轻轻插入SMA进行病毒注射(1*10E11vg, 200μL体积的AAV8)。将固定带轻扎血管,防止注射部位泄漏。
注:注射过程中使用显微镜观察以确保注射可视准确。
(6)注射后立即取下针头,缝合注射部位。取下固定带和微血管夹,使血液回流至小肠。使用无菌棉签轻轻按压注射部位进行止血。
(7)在腹腔内注射1ml无菌温盐水后,对小鼠进行缝合。
(8)术后每15min对小鼠进行一次监测,直到小鼠能够腹卧。每2小时对动物进行一次监测,直至放回笼中。