 当前位置:首页 > 专题 > 帕金森造模工具
当前位置:首页 > 专题 > 帕金森造模工具
一、认识帕金森病
帕金森病(Parkinson’s Disease, PD)是除阿尔茨海默病外,世界第二大的神经退行性疾病。其症状主要表现为运动障碍或迟缓、僵直、静止震颤等,并可能伴有感知认知障碍。帕金森病在老年人群中的发病率很高,60岁以上老年人的患病率超过2%。目前,我国的帕金森病患者约有200万人,占全世界帕金森病人的一半左右,在我国老龄化逐渐加重的社会背景下,帕金森病已经成为威胁老年人群身心健康的一大“杀手”。帕金森病的病因至今尚不明确,有研究表明遗传、环境污染、衰老、焦虑、抑郁和心血管疾病等因素均参与了多巴胺能神经元的死亡过程,因此迫切需要建立有效的帕金森病动物模型,用以研究致病机制并探索临床治疗手段。
二、帕金森病造模方案
帕金森病的突出病理改变包括黑质中多巴胺能神经元的变性死亡、由α-突触核蛋白组成的路易小体的错误折叠及积累。目前有两种主流的帕金森病造模方案,分别是基于神经毒素杀伤多巴胺能神经元的造模方案和基于α-突触核蛋白的造模方案。
MPTP(1-甲基-4-苯基-1,2,3,6-四氢吡啶)和6-OHDA(6-羟多巴胺)是两种常用的神经毒素。MPTP在胶质细胞中被单胺氧化酶B代谢为MPDP+中间体,随后中间体进一步转化为有毒物质MPP+,MPP+抑制多巴胺能神经元线粒体呼吸链复合体I的活性,阻断电子转移链,抑制ATP的生成并促进活性氧的产生,导致神经元损伤(图1);6-OHDA是多巴胺的羟基化衍生物,化学结构与多巴胺类似,通过多巴胺或去甲肾上腺素转运体进入神经元后会被单胺氧化酶A催化形成过氧化氢等毒性物质,并导致细胞结构和代谢紊乱,最终造成神经元的损伤(图2)。
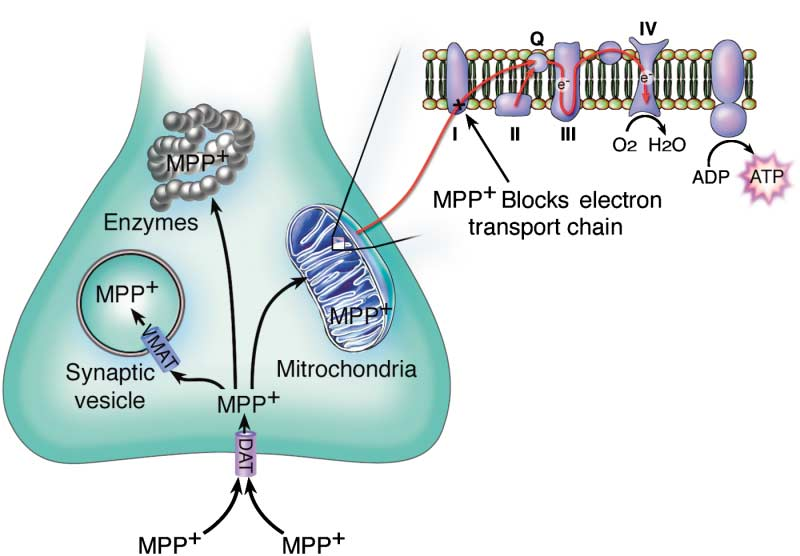
图1. MPTP代谢及作用机制示意图(Dauer W et al., Neuron. 2003)
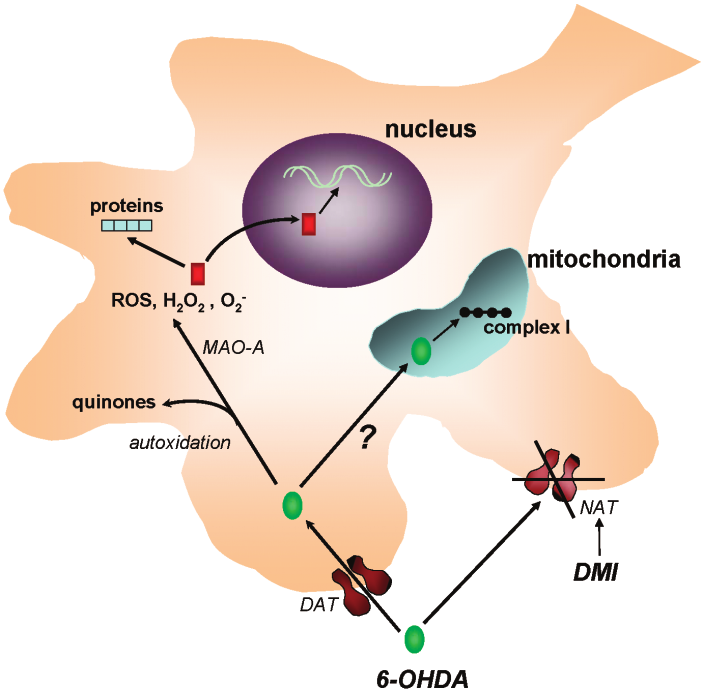
图2. 6-OHDA诱导神经毒性的机制示意图(Simola N et al., Neurotox Res. 2007)
α-突触核蛋白(α-Syn)由SNCA基因编码,主要在突触前和核周表达,并可能与突触可塑性或神经递质释放相关。生理条件下,α-Syn以可溶性单体或四聚体的构象形式存在;病理状态下,α-Syn的构象转变为β折叠形式,错误折叠的α-Syn会聚集形成寡聚体,并逐渐发展为纤维原和不溶性纤维,细胞内细胞器被相互隔离和干扰,最终形成路易小体(Lewy body),进而导致神经元病变。A53T是α-突触核蛋白(SNCA)的突变体,该突变体的聚集效果明显强于非突变型α-突触核蛋白,在神经元内可以更高效的形成路易小体,进而导致帕金森病的发生,借助AAV递送SNCA (A53T)可以高效稳定的诱导帕金森疾病的产生和发展。
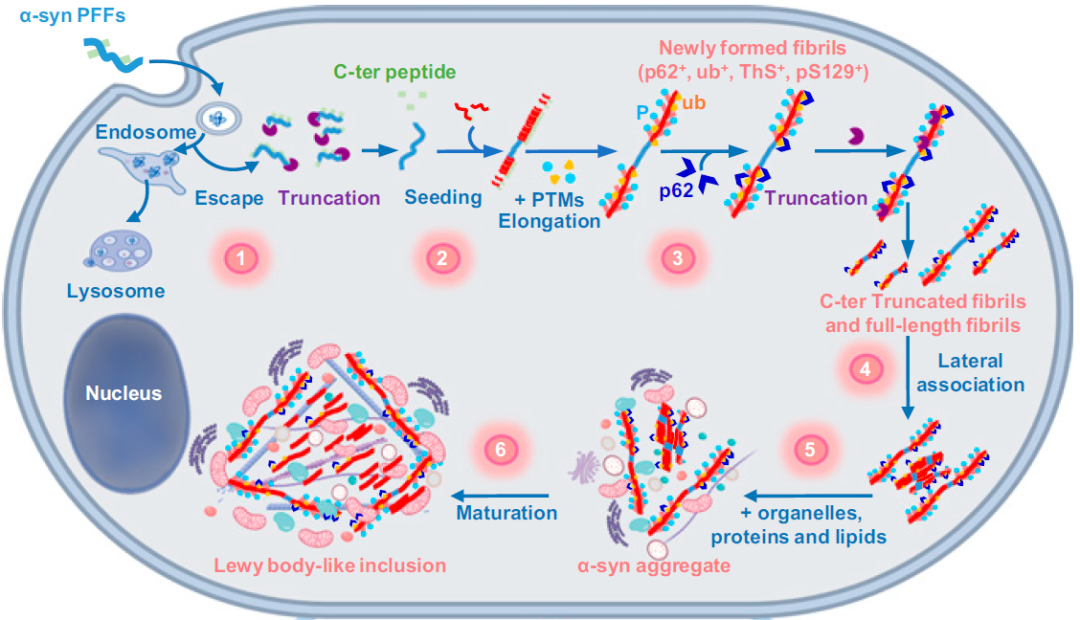
图3. α-Syn形成路易小体的机制示意图
(Mahul-Mellier et al., PNAC.2020)
三、维真多样化帕金森造模工具AAV现货供应
维真生物可提供包括AAV-hSNCA(WT)、AAV-hSNCA(A53T单突)、AAV-hSNCA(A30P单突)、AAV-hSNCA(A30P、A53T双突)等在内的SNCA野生型和多种突变型帕金森造模工具AAV,现货供应,大大加快研究周期,是您帕金森造模的理想选择!3万余单病毒包装经验,质量有保证!
相较于神经毒素的造模方案,利用AAV递送SNCA的优势在于:
1、更高的安全性:MPTP是有毒化合物,使用相对危险,AAV-SNCA更安全稳定。
2、更能模拟疾病发展过程:神经毒素是直接杀伤多巴胺神经元,AAV表达时程长,可以更好地模拟帕金森病发生发展的全过程,有利于发现和识别新的治疗靶点。
3、更加多样化的选择:不同的AAV血清型,各类广谱或特异性启动子等,适应不同的实验需求。病毒注射量低,相对稳定安全。
四、AAV-SNCA(A53T)造模案例分享
作者将AAV1/2-A53T-αSyn转导小鼠脑黑质神经元,发现αSyn在黑质多巴胺能神经元中大量表达。通过检测路易小体病理结构的产生和分析小鼠运动模式发现:AAV1/2-A53T-αSyn小鼠满足PD模型所需的多个标准,包括黑质纹状体的变性,与人类PD相似的路易样病理特征和小鼠行为缺陷。表明AAV-A53T帕金森病模型能进一步用于研究帕金森病的分子机制,探索新的疗法和药物临床前测试。
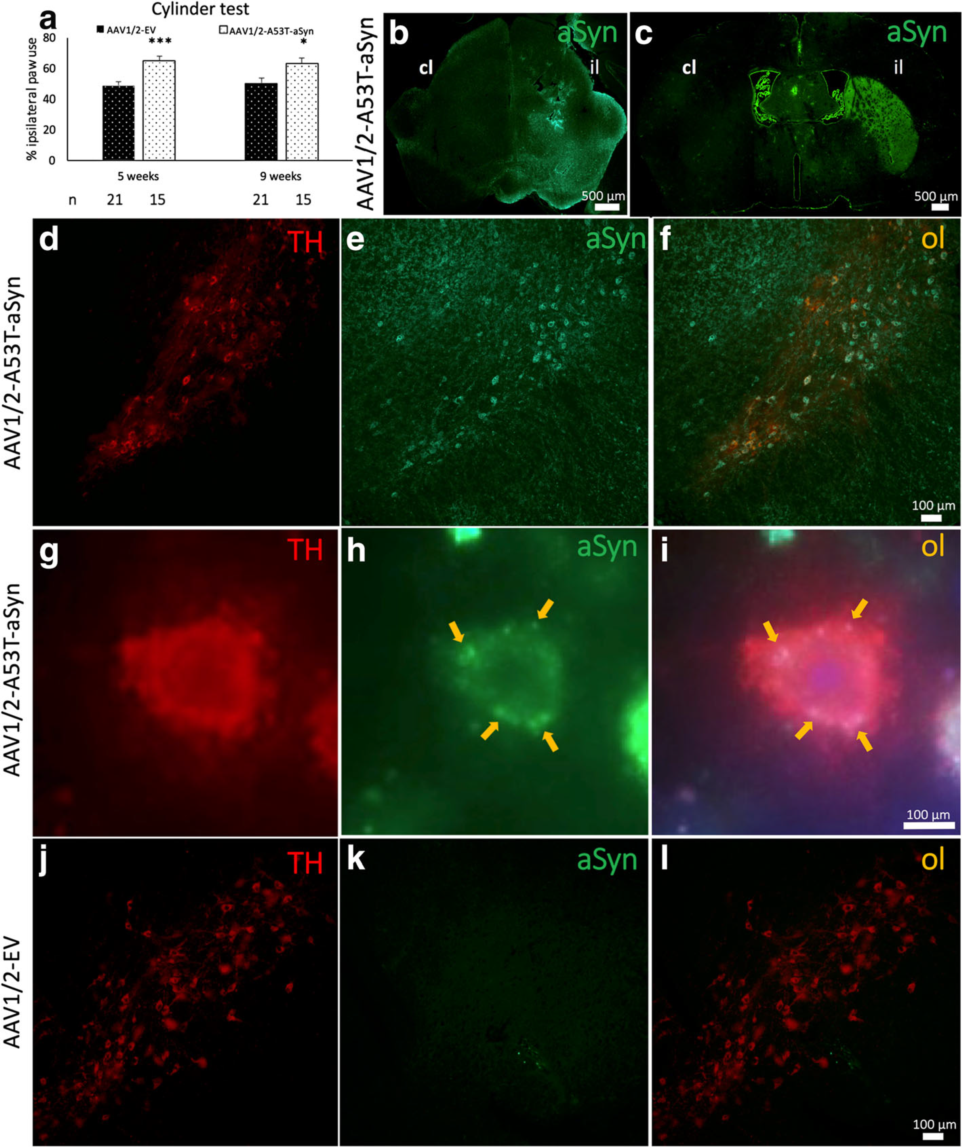
图4.αSyn在多巴胺能神经元中大量表达并导致行为缺陷
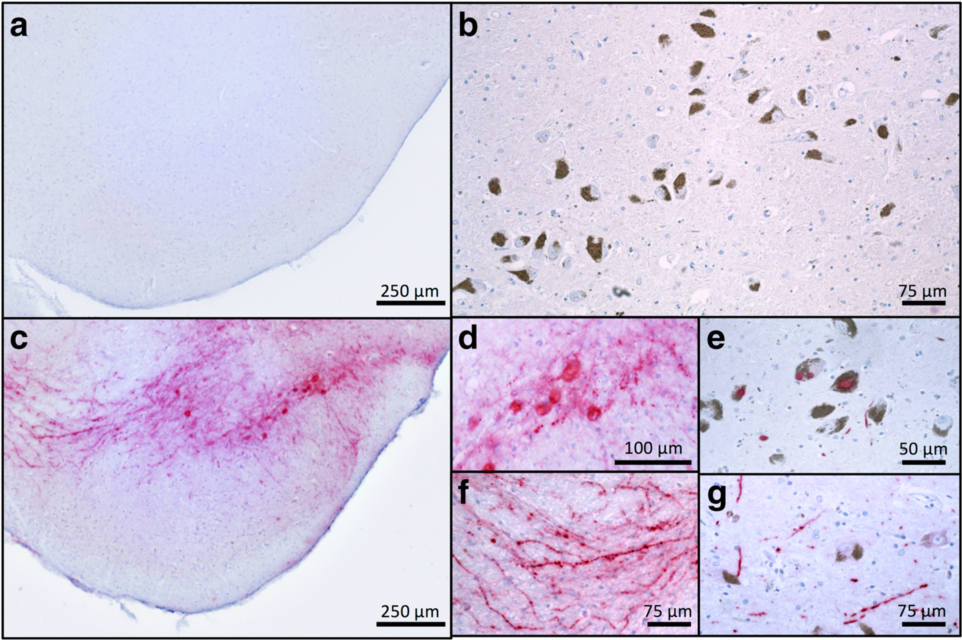
图5. AAV1/2-A53T-αSyn导致小鼠出现与PD患者类似的路易样病理
(Ip et al., ACTA NEUROPATHOL COM. 2017)
更多帕金森造模案例可参考
[1] Marusela Oliveras-Salvá, Perren, A., Casadei, N., Stroobants, S., Nuber, S., & R D’Hooge, et al. (2013). Raav2/7 vector-mediated overexpression of alpha-synuclein in mouse substantia nigra induces protein aggregation and progressive dose-dependent neurodegeneration. Molecular Neurodegeneration, 8(1), 44.
[2] Rocha, E.M., Smith, G.A., Park, E., Cao, H.M., et al. (2015). Glucocerebrosidase gene therapy prevents α-synucleinopathy of midbrain dopamine neurons. Neurobiology of Disease, 82, 495-503.
[3] Karikari, A.A., Mcfleder, R.L., Ribechini, E., Blum, R., Bruttel, V., & Knorr, S., et al. (2022). Neurodegeneration by α-synuclein-specific T cells in AAV-A53T-α-synuclein parkinson's disease mice. Brain, Behavior, and Immunity, 101, 194-210.
[4] Becker, G., Michel, A., Bahri, M.A., Mairet-Coello, G., Lemaire, C., & Deprez, T., et al. (2021). Monitoring of a progressive functional dopaminergic deficit in the A53T-AAV synuclein rats by combining 6-[18f]fluoro-L-m-tyrosine imaging and motor performances analysis. Neurobiology of Aging, 107, 142-152.