当前位置:首页 > 研究领域 > 其他
当前位置:首页 > 研究领域 > 其他

自噬是一种进化上非常保守的由溶酶体介导的生物降解过程,对细胞内稳态具有重要的调控作用。自噬过程由复杂的分子网络调控,包括UNC-51样激酶1(ULK1)复合物、III类磷脂酰肌醇3-激酶(PI3K)复合物及多种自噬相关基因。此外,磷酸化、糖基化、泛素化和乙酰化等在内的翻译后修饰(PTMs)也介导自噬发生。最近的研究表明,乳酸可以驱动组蛋白和非组蛋白的赖氨酸乳酸化,是一种新的翻译后修饰,并以糖酵解依赖的方式调节巨噬细胞、体细胞、癌细胞和脑细胞的基因表达和蛋白活性。然而,乳酸化是否参与调节自噬机制目前尚不清楚。华东理工大学的研究团队发现ULK1通过磷酸化乳酸脱氢酶A(LDHA)促进乳酸产生,并进一步乳酸化Vps34激活其激酶活性,促进细胞自噬发生和内体-溶酶体降解途径,揭示了糖酵解代谢产物乳酸调控细胞自噬的新机制,以及Vps34乳酸化在肌肉运动稳态和肿瘤进展中的作用。



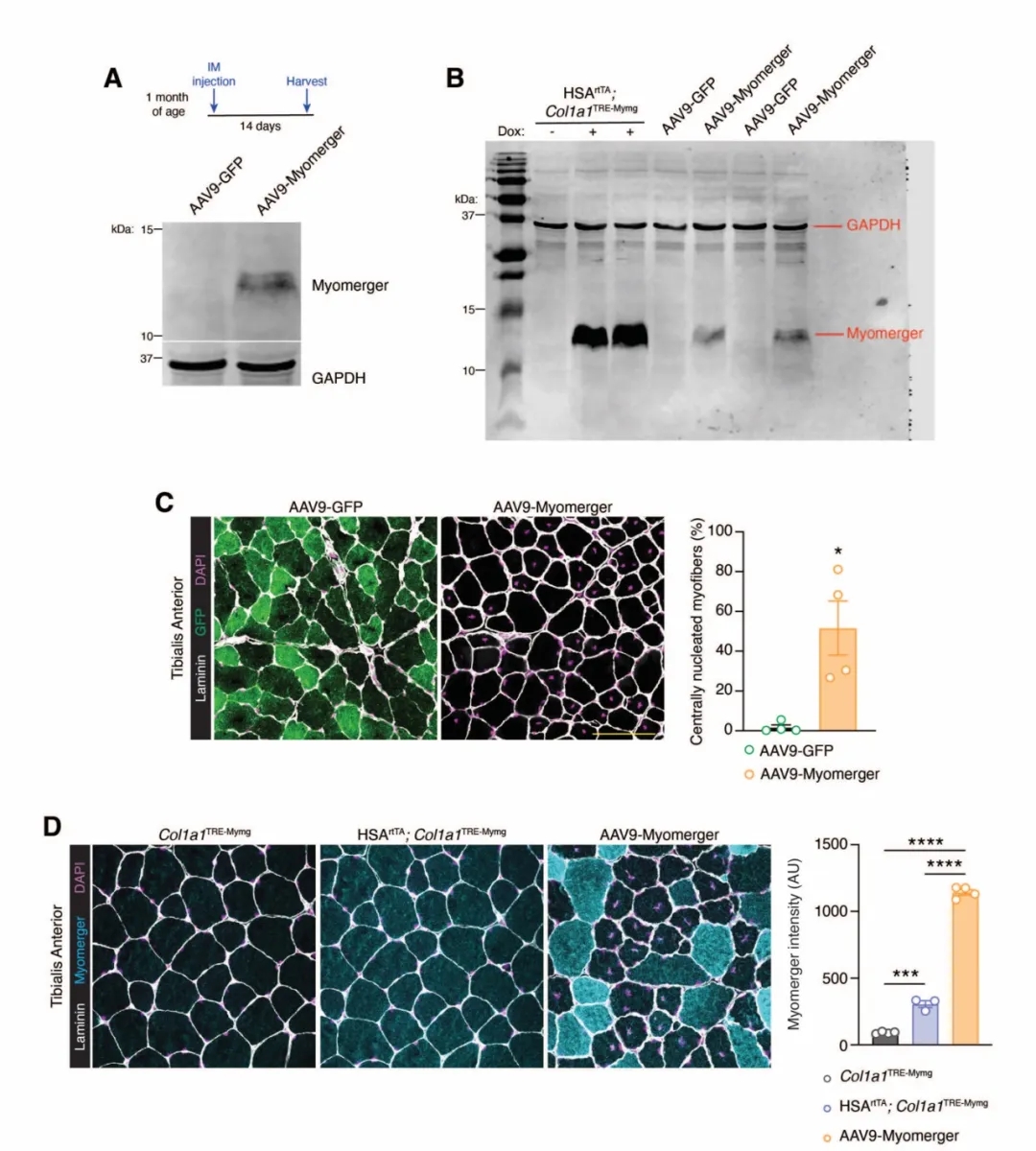
糖基化相关蛋白异常先天性肌营养不良(dystroglycanopathy)是一组新生儿或婴儿期起病、具有明显临床表现和遗传异质性的肌营养不良性疾病,FKRP基因的突变易导致dystroglycanopathy,疾病严重程度从轻度LGMD2I到重度CMD。近年来,针对该类疾病的AAV基因治疗和ribitol(核糖醇)治疗均显示出显著的疗效,然而每种治疗方法都有其优缺点。Atrium Health卡罗来纳医疗中心的研究团队在FKRP-P448L突变小鼠中检测了AAV基因治疗和ribitol的联合治疗效果。研究结果证实,长期单独使用核糖醇治疗可以改善营养不良小鼠的病理、肌肉功能和寿命,但联合AAV-FKRP基因治疗比单独治疗更有效,揭示了核糖醇与AAV基因疗法联合治疗FKRP相关肌营养不良的潜在益处。

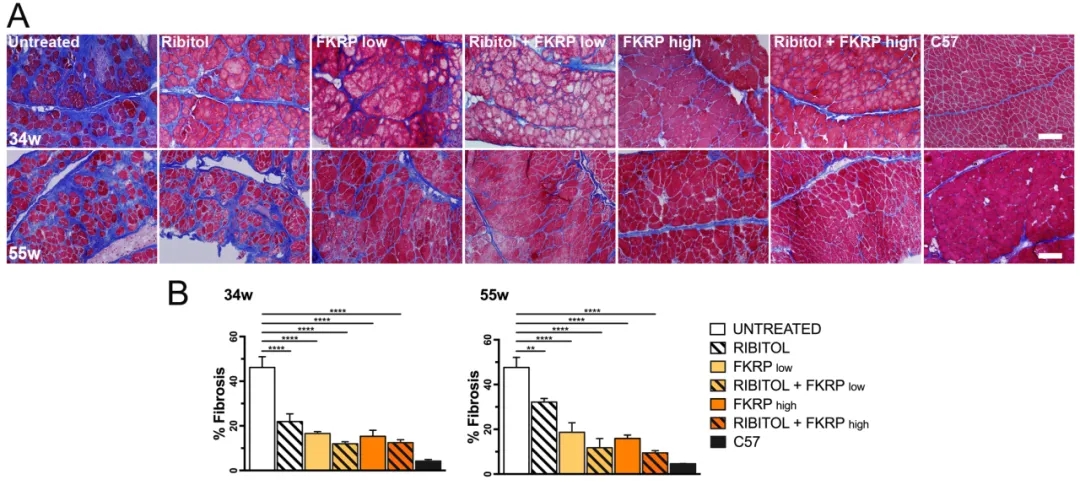

线粒体Ca2+单向转运蛋白(MCU)复合物介导急性线粒体Ca2+内流。在骨骼肌中,MCU通过直接增强线粒体中关键代谢酶的活性,将Ca2+信号传导与能量产生联系起来。辛辛那提儿童医院的研究人员通过建立胚胎、出生后和成年时期骨骼肌中靶向缺失MCU的小鼠模型,研究了MCU在骨骼肌发育和代谢功能中的作用。研究结果表明Mcu的缺失不会影响肌肉的生长和成熟,也不会引起病理,小鼠骨骼肌特异性Mcu缺失也不影响肌纤维细胞内Ca2+处理,但抑制了Ca2+刺激的急性线粒体Ca2+内流和线粒体呼吸,导致小鼠急性运动能力下降。然而,Mcu的损失也导致疲劳条件下肌肉性能的增强,优先转向脂肪酸代谢,导致体脂随着年龄的增长而减少。总之,这些结果表明,MCU介导的线粒体Ca2+调节是基线和生理需求增强条件下骨骼肌燃料选择的基础,影响了总的稳态代谢。


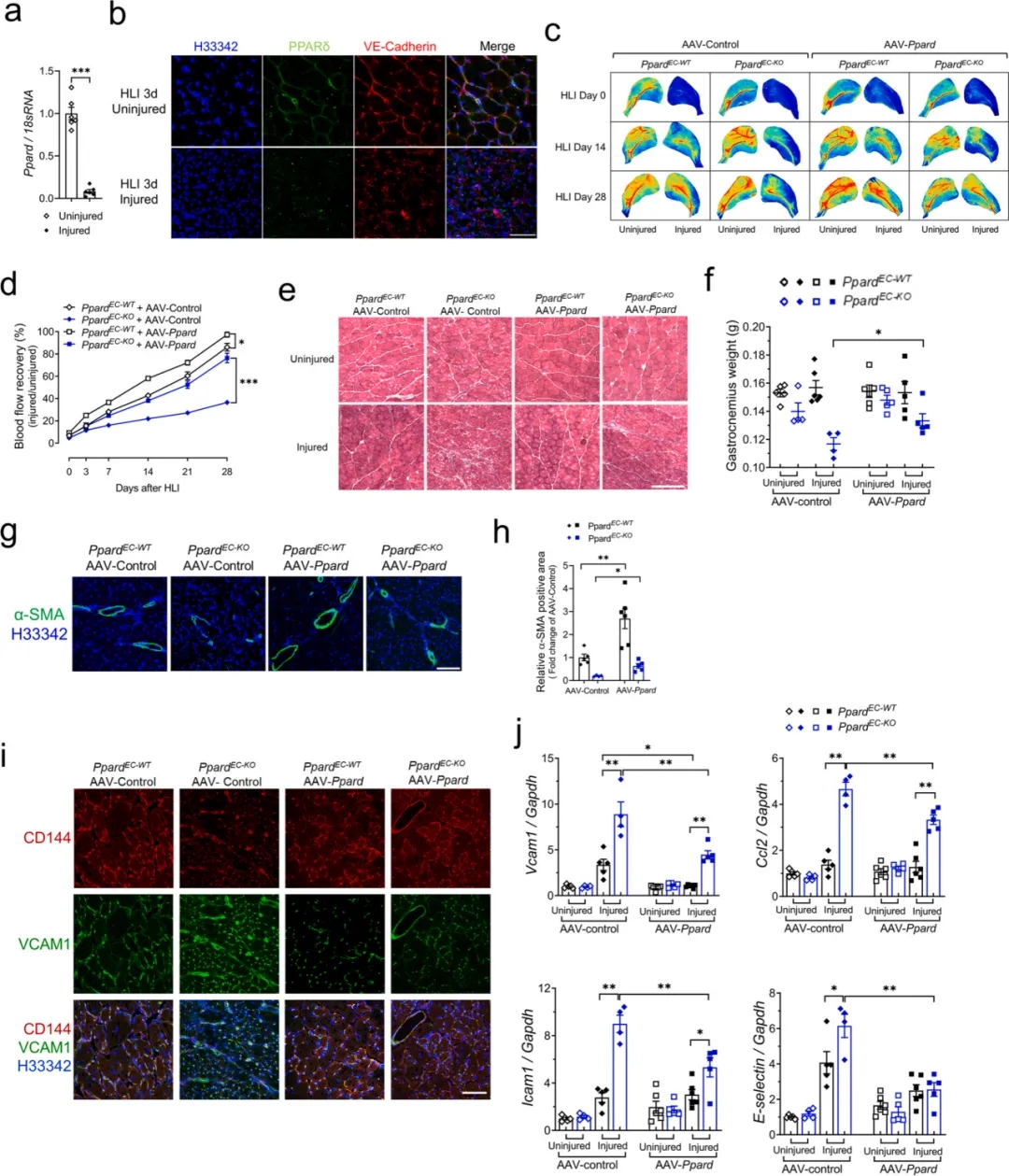
糖尿病血管病变是造成糖尿病人群发病和死亡的主要原因,外周动脉疾病(PAD)是其主要形式之一。PAD是一种以向下肢提供血液和营养的动脉狭窄和闭塞为特征的动脉粥样硬化性心血管疾病,严重时可发展成重症肢体缺血(CLI),已知肥胖和胰岛素抵抗与PAD和CLI的发病率呈正相关。目前,抗炎、刺激血管重建和肌肉再生是治疗CLI的关键途径,但是由于缺乏有效的治疗靶点和途径,针对CLI的临床治疗效果是有限的。过氧化物酶体增殖物激活受体δ (PPARδ)是一种配体激活的核转录因子,属于核受体超家族。使用PPARδ激动剂激活PPARδ对血管内稳态和冠状动脉疾病有显著治疗效果,然而其副作用在很大程度上限制了该治疗方法的进一步应用。香港中文大学的研究团队探索了AAV载体介导的PPARδ传递对下肢缺血诱导的血管损伤的治疗效果,研究表明在肥胖和胰岛素抵抗的情况下,PPARδ在内皮稳态中发挥关键性保护作用。利用AAV1靶向内皮细胞转导PPARδ的基因疗法有助于缺血性损伤后功能性血管系统恢复,包括增强血流恢复,增加毛细血管密度,恢复内皮完整性,抑制血管炎症,并能促进肌肉的再生,突出了PPARδ在PAD和CLI患者治疗中的潜在巨大价值。


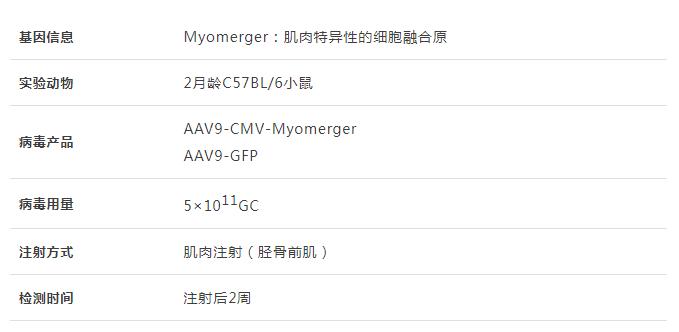
骨骼肌的发育和再生依赖于肌源性祖细胞的细胞融合来产生多核肌纤维,这些祖细胞利用Myomaker和Myomerger两种肌肉特异性融合原,它们通过重塑细胞膜相互融合或与现有肌纤维融合而发挥作用。Myomaker和Myomerger的表达仅限于分化祖细胞,因为它们在成年肌纤维中未被检测到,然而,肌营养不良小鼠的肌纤维中仍然表达Myomaker。辛辛那提儿童医院的研究团队评估了肌纤维区室中Myomaker和Myomerger活性的影响,研究发现肌纤维中Myomaker或Myomerger的表达在急性时间点独立引起膜损伤,这种损伤导致肌肉病理,表现为中央有核肌纤维和肌肉萎缩,与融合蛋白自身的表达相比,肌纤维中Myomaker和Myomerger的双重表达加剧了肌肉病理学。数据表明,虽然肌纤维可以耐受一定水平的Myomaker和Myomerger,但超过阈值的单个融合蛋白的表达或两种融合蛋白的共同表达对肌纤维是有害的,强调了在肌肉发生和融合过程中高度限制融合蛋白表达的必要性。