当前位置:首页 > 研究领域 > 其他
当前位置:首页 > 研究领域 > 其他
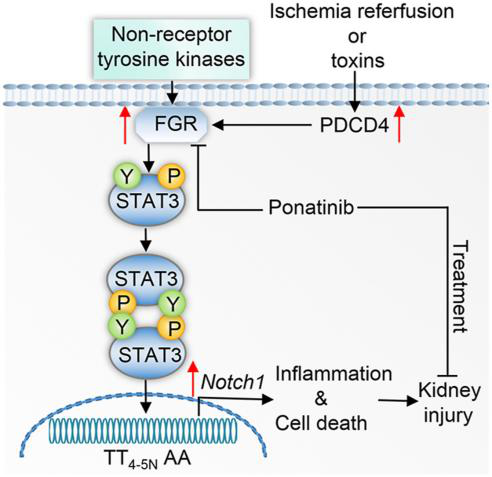
急性肾损伤(Acute kidney injury, AKI)是一种发病率和死亡率均较高的常见疾病,缺血/再灌注损伤(ischemia/reperfusion injury, IRI)、败血症或毒素引起的急性和慢性免疫反应会导致AKI。程序性细胞死亡因子4(PDCD4)是一种多功能的肿瘤抑制因子,并参与炎症的诱导,但其在AKI中的作用和机制尚不清楚。据报道,NOTCH1信号通路的过度激活参与肿瘤的形成、肾脏纤维化及足细胞损伤,表明其在肾脏中发挥重要作用,但其具体调控机制尚不明确。
在本研究中,作者采用肾缺血再灌注损伤(IRI)和顺铂诱导的AKI小鼠模型,发现PDCD4在AKI小鼠中表达丰富,其缺失可显著改善AKI小鼠的肾功能障碍和炎症反应,不仅如此,急性肾小管坏死患者的肾脏活检中也发现PDCD4表达上调。进一步研究发现,酪氨酸激酶家族成员Fgr的过表达可显著加重AKI小鼠模型的病症,并消除了PDCD4缺失对肾脏的保护作用。机制上,PDCD4通过磷酸化STAT3正向调控FGR/ NOTCH1介导的细胞凋亡和炎症通路进而加重AKI。全身给药帕纳替尼(ponatinib,一种酪氨酸激酶抑制剂)可阻断该通路改善小鼠肾损伤。本研究揭示了PDCD4在AKI中的作用和分子机制,提示在多个水平上靶向PDCD4信号通路可能是治疗AKI的有效策略,为开发改善AKI的疗法提供了新见解。
| 病毒产品 | rAAV9-Fgr-GFP & rAAV9-GFP |
|---|---|
| 病毒滴度 | 8.0 x 10E12 vg/mL |
| 注射方式 | 肾实质注射 |
| 注射剂量 | 6 x 10E11 vg |
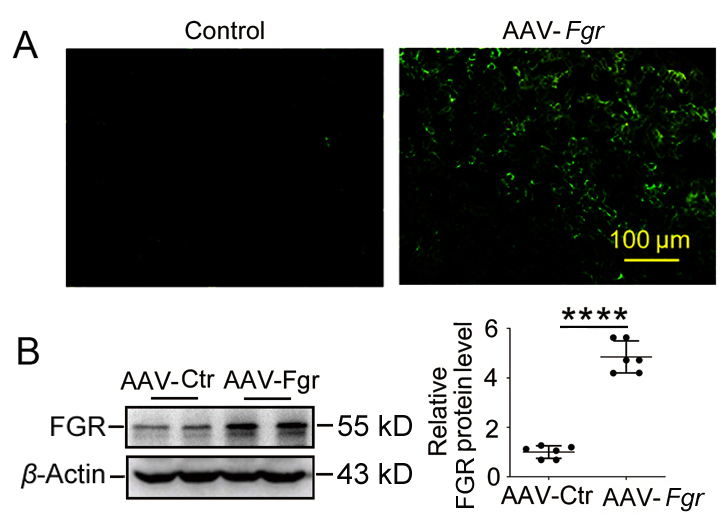
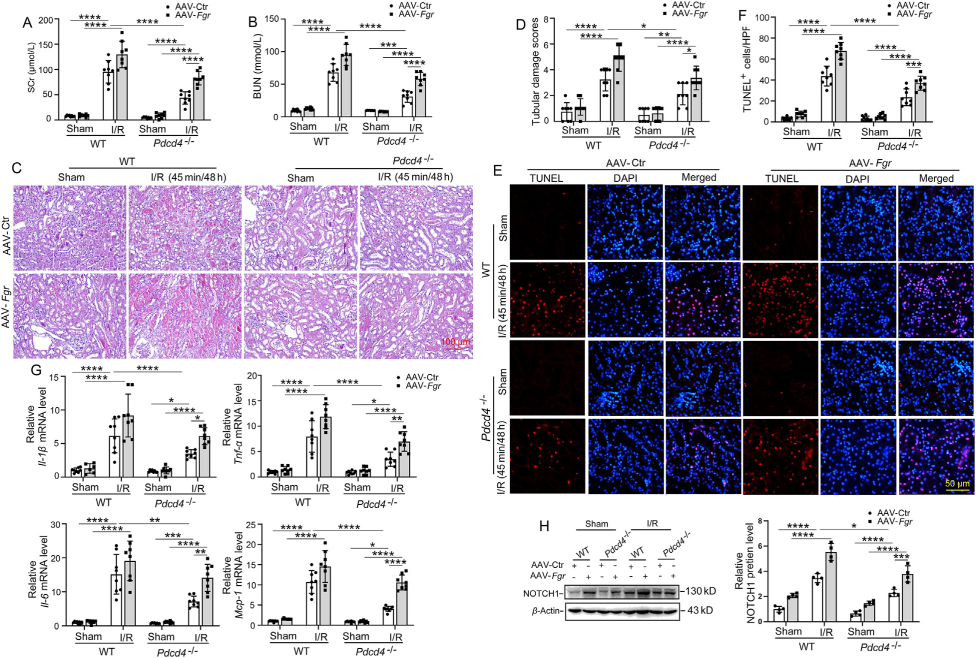
为探究Fgr是否是连接PDCD4和AKI炎症反应间的关键调节因子,作者将rAAV9-Fgr-GFP通过肾实质注入Pdcd4-/-缺血小鼠体内,1个月后通过荧光显微镜观察到强烈的绿色荧光,Western Blot也证实了Fgr成功过表达(图2)。
如图3所示,FGR的过表达消除了Pdcd4-/-缺血小鼠的肾损伤减轻症状,具体表现为血清肌酐SCr和血尿素氮BUN升高,肾形态损伤恶化,细胞死亡、炎症反应以及巨噬细胞、中性粒细胞浸润增强。重要的是,FGR的过表达还逆转了Pdcd4-/-缺血小鼠NOTCH1的下调。上述结果表明Fgr在AKI中是PDCD4和炎症反应的关键调节因子。
慢性肾脏病导致的肾纤维化是终末期肾衰竭(尿毒症)的主要原因。研究表明,转化生长因子TGF-β1信号通路在肾间质纤维化过程中起到重要作用,在TGF-β刺激下,信号转运蛋白Smad3的磷酸化是整个TGF-β/Smad3通路活化的关键环节。然而敲除Smad3治疗肾纤维化的同时也会引发自身免疫性疾病,因此,寻找一种能抑制TGF-β/Smad通路减轻肾纤维化而又不损害免疫系统的替代方法是至关重要的。研究表明lncRNA在肾脏疾病的发病机制中发挥关键作用,然而研究大多针对小鼠lncRNA,关于lncRNA在人肾脏中的作用研究相对较少。此外,lncRNA在调节人类肾纤维化中的生物学作用也尚不清楚。
在本研究中,作者用TGF-β进行诱导,并通过高通量筛选技术,观察肾小管上皮细胞中差异表达的lncRNA的表达,发现在TGF-β刺激下lnc-TSI的表达显著增加。在生物学功能上,研究者发现lnc-TSI通过特异性抑制Smad3的磷酸化负向调控TGF-β/Smad3信号通路。分子机制研究发现,lnc-TSI可以通过结合Smad3的MH2结构域而阻止TGFβ I型受体和Smad3的结合。动物实验表明,通过腺相关病毒AAV9实现人源基因lnc-TSI在小鼠肾脏中的过表达有效防治了小鼠肾纤维化模型的发生发展。本研究为肾纤维化的治疗提供了一个新的潜在靶点。
| 基因名称 | 长非编码RNA lnc-TSI |
|---|---|
| 病毒产品 | AAV9-lnc-TSI-GFP |
| 注射方式 | 左肾静脉注射 |
| 注射量 | 100μL病毒稀释液 (1x10E12 vg/只) |
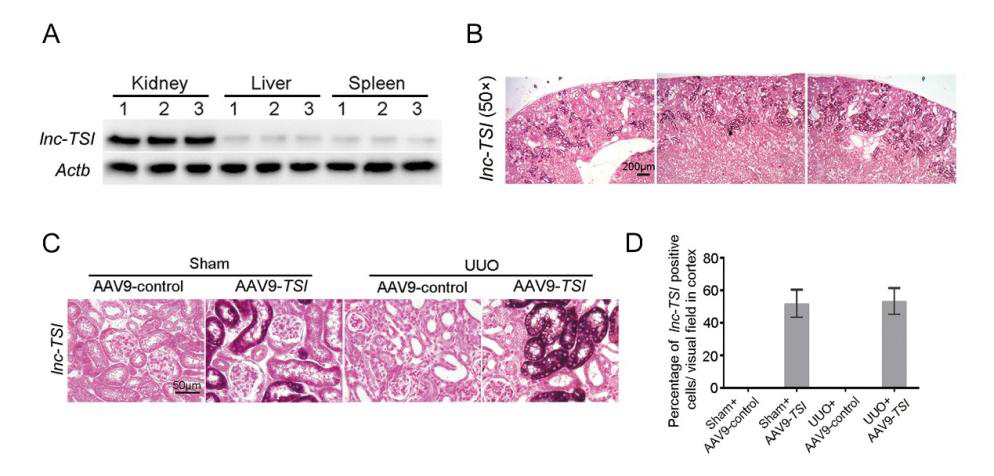
研究者采用单侧输尿管结扎(Unilateral Ureteral Obstruction, UUO)方法,于术前一周进行小鼠肾静脉注射。用生理盐水将10μL腺相关病毒(AAV9-lnc-TSI,1×10E14 vg/mL)稀释至100μL体积,每只小鼠使用100μL病毒稀释液,于造模一周后处死小鼠。Northern blot实验证明,这种感染方法可以使lnc-TSI主要表达于肾脏中。同时,使用RNA原位杂交发现,病毒感染使lnc-TSI主要表达于肾皮质的肾小管上皮细胞中,皮质中被感染成功的细胞百分比约为40-60%。
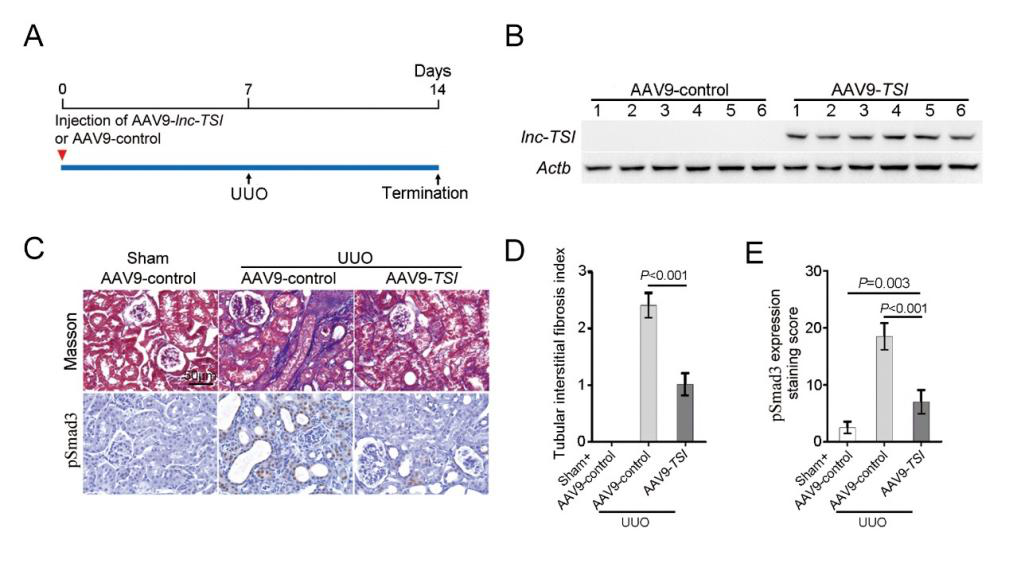
Northern blot结果显示,lnc-TSI在小鼠肾脏中成功过表达。并且,在小鼠肾脏中特异过表达lnc-TSI可以有效减轻单侧输尿管结扎(UUO)所致的肾间质纤维化,表现为肾间质纤维化评分(TIF index)降低和肾小管中pSmad3蛋白的表达下降。
糖尿病肾病(DN)是糖尿病的严重并发症,金丝桃苷已被广泛报道可用于改善糖尿病相关疾病,但金丝桃苷调控DN的具体作用及机制尚未明确。现有研究表明,金丝桃苷可通过调节microRNA或靶向AKT/ mTOR通路调控DN进展,此外,在DN中某些miRNAs能靶向Wnt/b-catenin信号通路,而这一通路的激活有助于肾脏的保护。
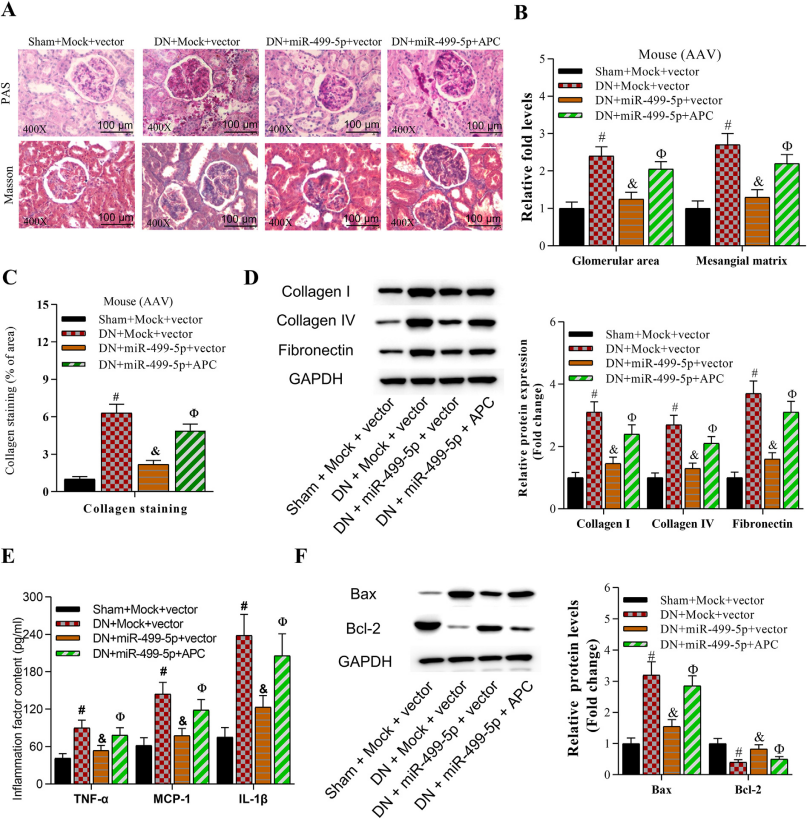
本研究中,作者通过建立糖尿病肾病小鼠模型,检测细胞外基质积累、炎症反应和细胞凋亡情况,发现金丝桃苷不仅能减轻高糖诱导的细胞损伤,还能改善糖尿病症状和肾功能障碍。机制上,miR-499-5p是腺瘤性息肉病基因APC (Wnt信号通路的负调控因子) 的上游负调节因子,金丝桃苷通过诱导miR-499-5p的上调抑制APC的表达,继而激活Wnt/b-catenin信号通路。本研究揭示了金丝桃苷通过靶向miR-499-5p/APC通路改善糖尿病肾病,为糖尿病肾病的治疗提供了一种潜在的策略。
| 病毒产品 |
AAV9-miR-499-5p & AAV9-APC |
|---|---|
| 实验动物 | 6-8周龄C57BL/6 雄性小鼠 |
| 注射方式 | 左肾静脉注射 |
| 注射量 | 1x10E12 copies |
| 检测时间 | 4周后 |
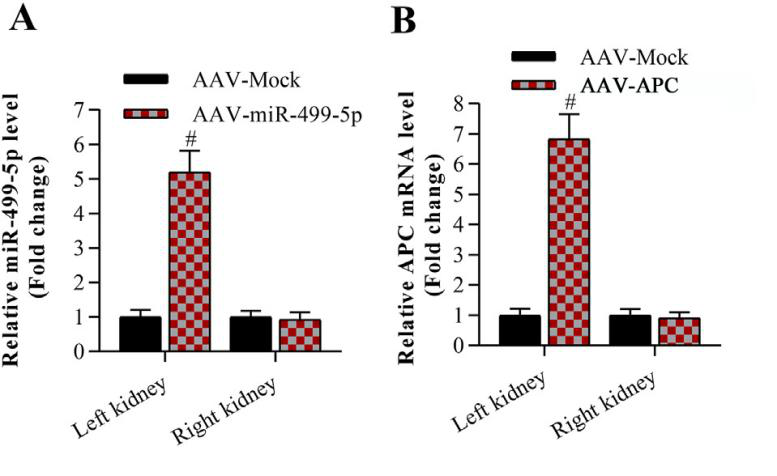
为探究金丝桃苷的具体调控机制,研究人员将AAV9-miR-499-5p及AAV9-APC通过肾静脉注射至小鼠左肾组织中,RT-qPCR检测证实miR-499-5p及APC在小鼠左肾组织中成功过表达(图6)。数据表明miR-499-5p和APC的过表达对糖尿病肾病小鼠的血糖、体重及血压等指标均无影响。此外,miR-499-5p对糖尿病肾病小鼠病症的抑制作用可被APC的过表达抵消(图7)。