 当前位置:首页 > 新闻中心 > 新闻资讯
当前位置:首页 > 新闻中心 > 新闻资讯
糖尿病视网膜病变(DR)是一种严重且相对未被认识到的糖尿病并发症,Müller神经胶质细胞遍及视网膜,在维持视网膜稳态中起着至关重要的作用。先前研究表明,胆汁酸激活GPCR家族成员TGR5可以改善DR,但TGR5在调节 Müller细胞功能中的作用及其机制尚不清楚。2023年9月1日,南京医科大学附属无锡人民医院姚勇和魏婷婷团队在Cell Death and Disease(IF 9.0)上发表论文“TGR5 supresses cGAS/STING pathway by inhibiting GRP75-mediated endoplasmic reticulum-mitochondrial coupling in diabetic retinopathy”,研究发现TGR5是维持线粒体功能的关键因素,TGR5激动剂可预防视网膜损伤,而TGR5敲低可加重DR大鼠视网膜损伤,表明TGR5可能是治疗DR的新靶点。
01 研究结果
1、TGR5激活通过减少线粒体损伤减轻DR中Müller细胞损伤
神经胶质细胞(Müller glial cells)遍布视网膜,发挥维持视网膜稳态和完整性的功能。免疫荧光染色结果提示TGR5在Müller细胞中表达,TGR5激动剂INT-777显著地挽救了高糖(HG)诱导的细胞活力下降。Müller细胞线粒体形态研究发现HG处理的细胞中线粒体分裂成短球体,INT-777显著恢复线粒体形态,进一步研究发现TGR5可能通过PKCδ-Drp1途径调节线粒体裂变。此外,INT-777上调线粒体呼吸链复合物如NDUFB8、SDHB、UQCRC2、MTCO1和ATP5A1的表达,且明显减轻随HG刺激而降低的MMP,表明TGR5激活改善了线粒体功能。通过转染TGR5特异性siRNA,发现TGR5的下调加重了HG诱导的线粒体断裂;同时,TGR5的下调导致MMP的降低。以上结果表明TGR5是介导线粒体功能的关键因素。

图1. TGR5激活通过减少线粒体损伤减轻DR中Müller细胞损伤
2、TGR5通过调节MAMs影响线粒体Ca2+稳态
作者进一步研究发现TGR5通过调节线粒体Ca2+水平来调节线粒体功能,MAMs介导Ca2+从内质网向线粒体的外排。HG处理的细胞中,MAM的形成增加,在INT-777处理后,线粒体和内质网之间的共定位显著减少。因此,作者推测TGR5介导的线粒体Ca2+稳态是由MAMs调节的。IP3R1-GRP75-VDAC1轴被证明存在于MAMs中,负责从内质网到线粒体的Ca2+运输。GRP75在HG条件下显著上调,而TGR5的激活逆转了其升高。免疫共沉淀和免疫荧光显示HG培养增加了GRP75与VDAC1以及GRP75与IP3R1的结合,而INT-777处理可以抑制这些结合。与HG组相比,TGR5敲低促进了MAM的形成并降低了线粒体Ca2+水平。然而,TGR5沉默对MAM形成和线粒体Ca2+过载的影响被GRP75沉默显著逆转。这些发现证实,TGR5抑制GRP75的表达导致IP3R1-GRP75-VDAC1复合物的形成受阻,从而降低线粒体Ca2+水平。
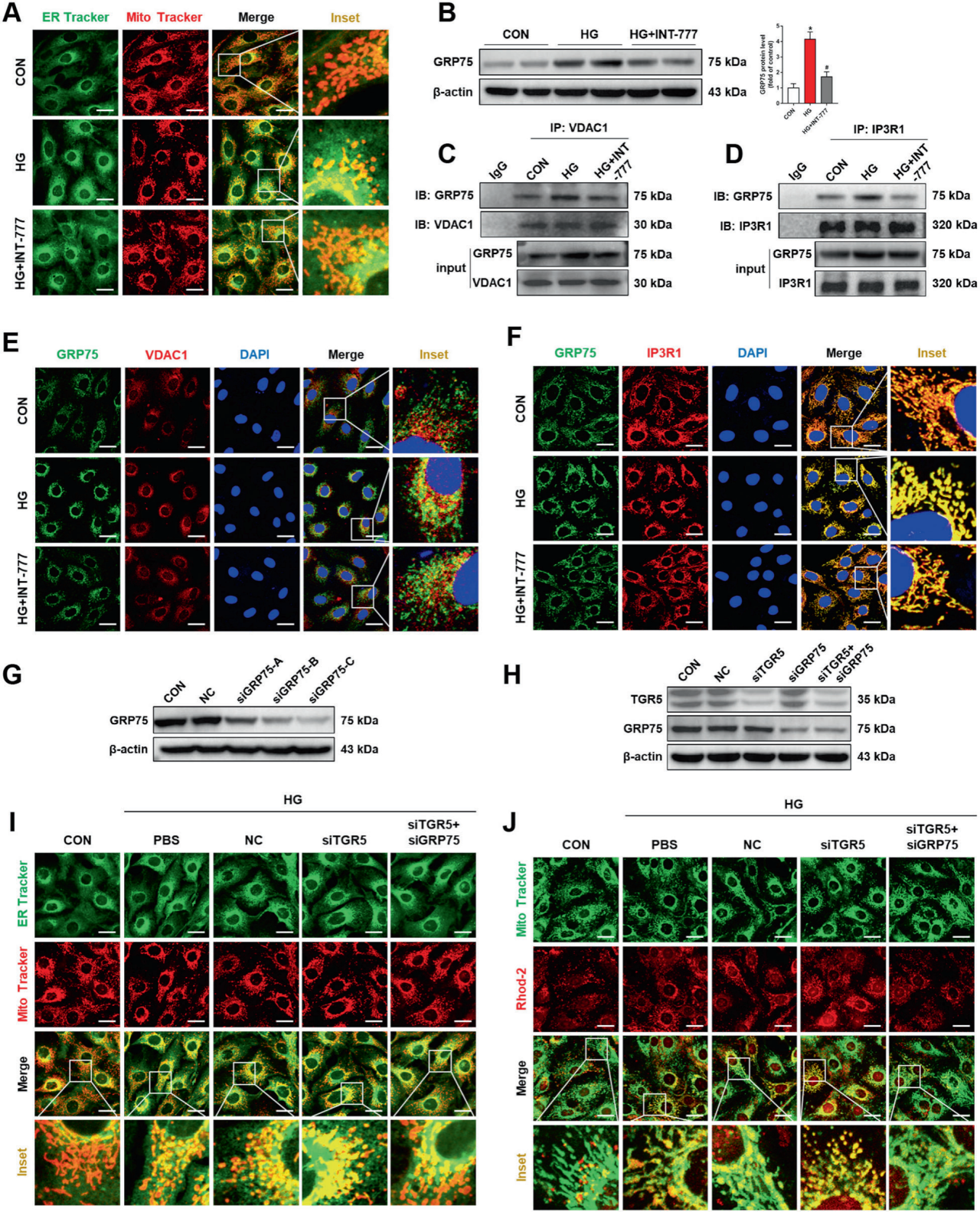
图2.TGR5通过调节MAM影响线粒体Ca2+稳态
3、TGR5激活可阻断cGAS-STING介导的炎症反应,减轻DR大鼠视网膜损伤
作者进一步探究TGR5对线粒体稳态和cGAS-STING通路的调控作用,发现TGR5激活可以维持线粒体稳态,进而抑制cGAS-STING介导的炎症反应。为进一步阐明TGR5在DR中的作用,作者利用STZ诱导的DR大鼠进行了后续实验。DR大鼠VEGF表达升高,而INT-777抑制其异常升高;同时,INT-777抑制DR大鼠的8-OHdG的上调,说明视网膜DNA损伤得到一定程度的修复。作者还观察到DR大鼠心肌细胞形态的异常,这种现象被INT-777改善。此外,WB分析显示,INT-777显著降低视网膜炎症因子TNF-α、IL-6和IFN-β的表达。与体外实验结果一致,DR大鼠视网膜中GRP75上调,cGAS-STING信号被激活,INT-777下调GRP75、cGAS和p-STING信号。综上所述,TGR5激活阻断了cGAS-STING介导的炎症反应,减轻了DR大鼠视网膜损伤。
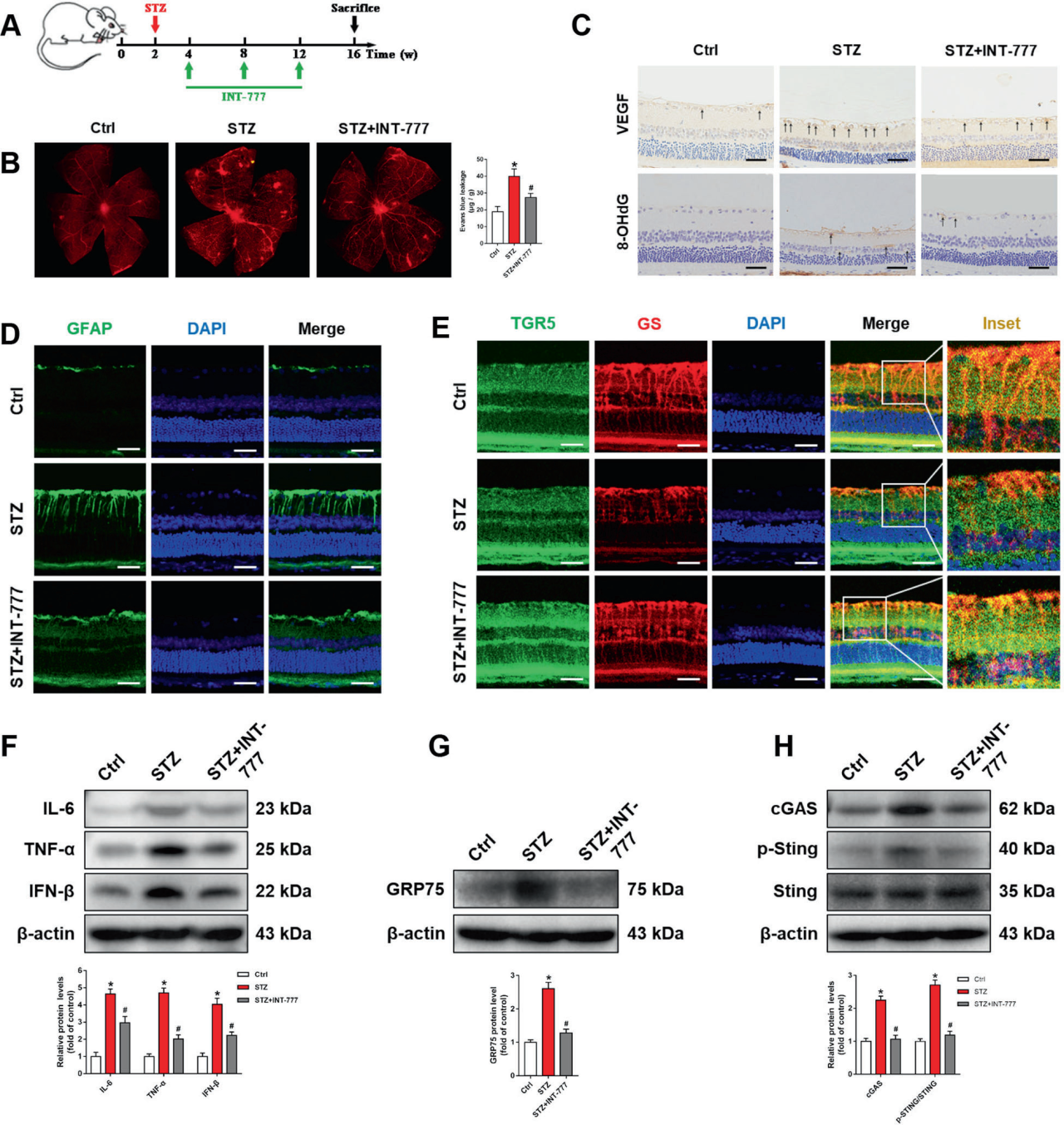
图3. TGR5激活可阻断cGAS-STING介导的炎症反应,减轻DR大鼠视网膜损伤
4、STING抑制剂可改善AAV-shTGR5诱导的DR大鼠视网膜功能障碍加重
接下来,作者探讨了TGR5与cGAS-STING之间的关系,利用AAV-shTGR5敲低DR大鼠视网膜TGR5,检测发现AAV-shTGR5显著沉默TGR5表达。与对照组相比,AAV-shTGR5组视网膜外核层(ONL)和内核层(INL)变薄,给药H-151可以逆转这一现象。在AAV-shTGR5组中,cleaved caspase-3显著上调,而H-151处理显著减少了视网膜细胞凋亡。STZ处理导致VEGF表达升高,AAV-shTGR5进一步强化VEGF表达,H-151逆转了这种效应。电镜显示糖尿病视网膜毛细血管基底膜较对照组明显增厚,AAV-shTGR5进一步加重了基底膜增厚。TGR5可能通过负调控cGAS-STING信号通路来影响Müller细胞的炎症反应。
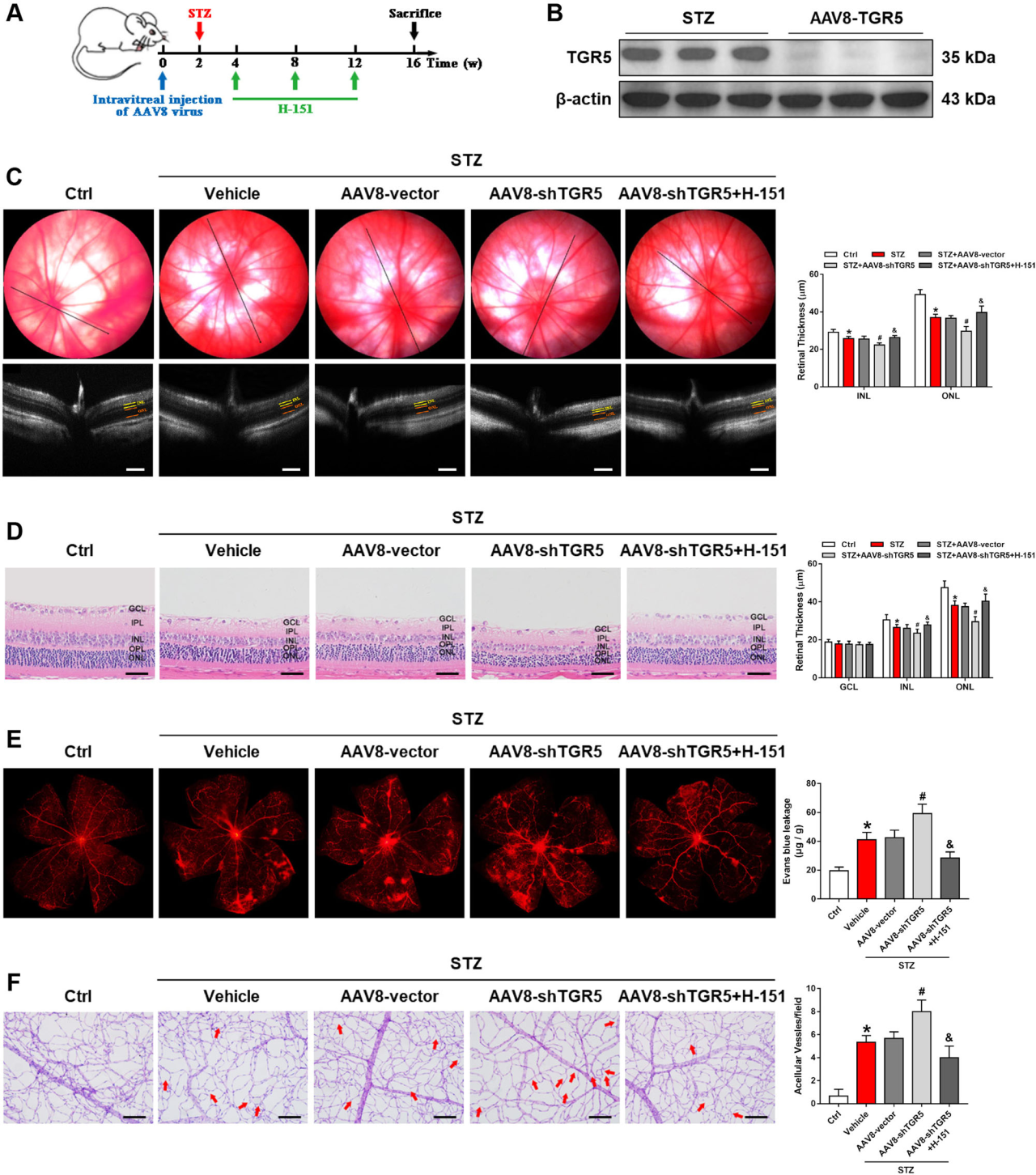
图4. STING抑制剂可改善AAV-shTGR5诱导的DR大鼠视网膜功能障碍加重
02 结论
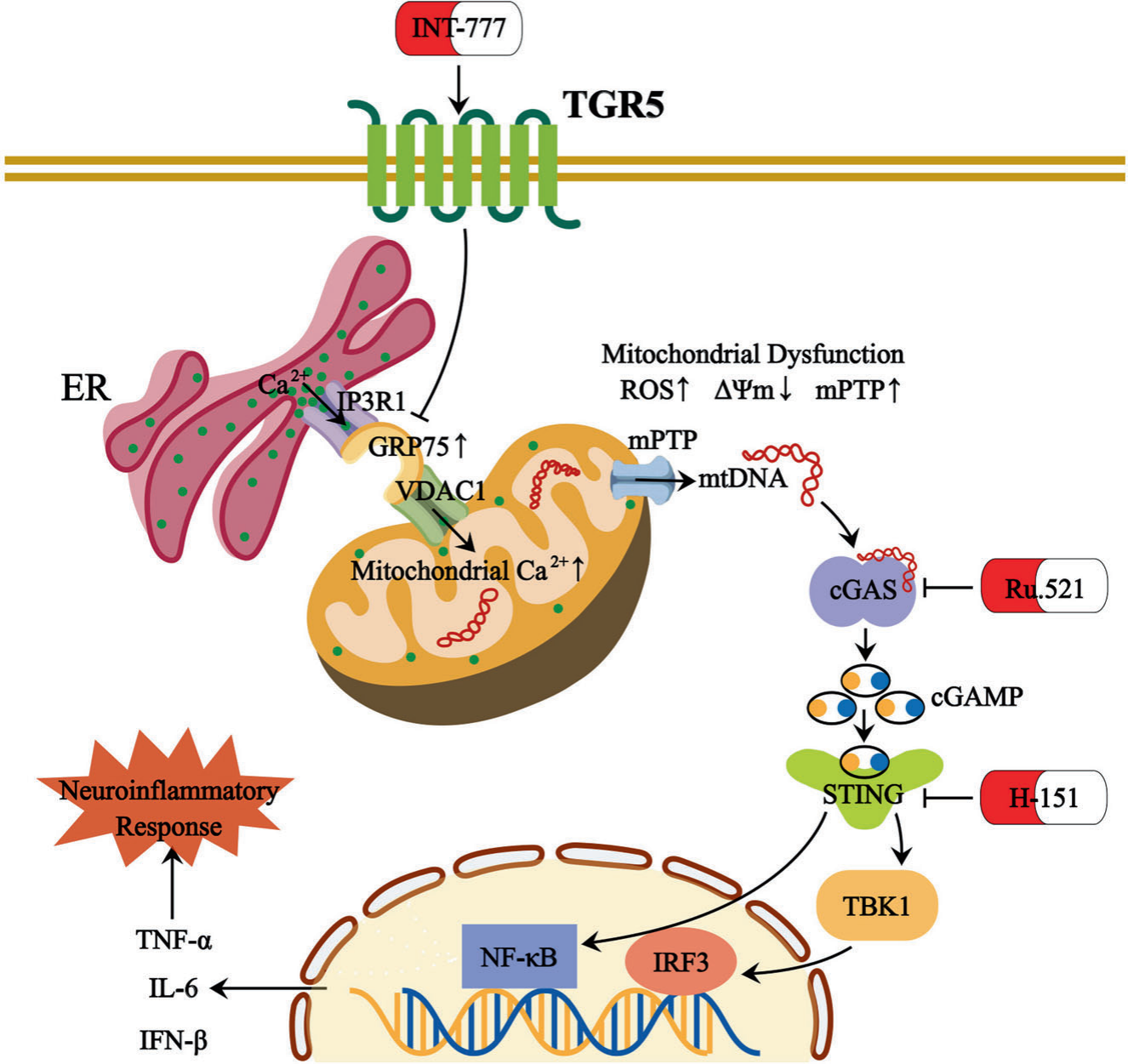
本研究证明了TGR5是维持Müller细胞线粒体功能的关键因子。TGR5激动剂下调MAMs形成,从而缓解线粒体Ca2+超负荷诱导的线粒体功能障碍。因此,在DR中,线粒体mtDNA释放减少,cGAS-STING信号介导的炎症反应被抑制。综上,本研究表明TGR5是DR的一个有前途的治疗靶点。
备案号:鲁ICP备13011878号 网址:www.wzbio.com.cn









