 当前位置:首页 > 专题 > 分子生物学
当前位置:首页 > 专题 > 分子生物学
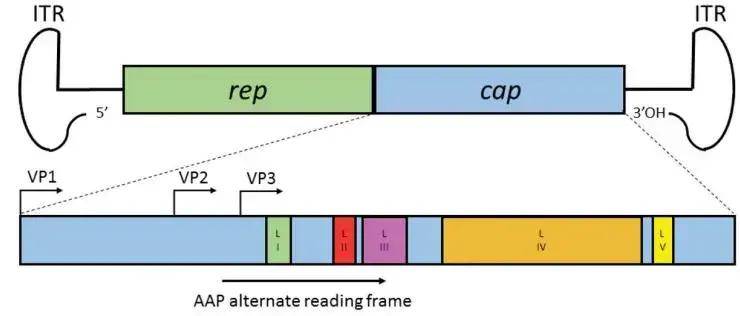
腺相关病毒(Adeno-associated virus,AAV)是一种单链DNA复制缺陷型细小病毒,它的生命周期依赖于复制病毒的参与。AAV基因组大小为4.7 kb,由末端反向重复序列ITR和中间的rep、cap基因组成。ITRs对于病毒的复制和包装具有重要作用;rep基因编码参与病毒复制、包装和基因组整合的非结构蛋白,cap基因编码结构蛋白VP1、VP2和VP3,3种蛋白分别按1:1:10的比例组装形成病毒衣壳,充当病毒基因传递载体。此外,cap基因内嵌套的另一个开放阅读框编码装配激活蛋白AAP,参与衣壳蛋白的靶向和装配。
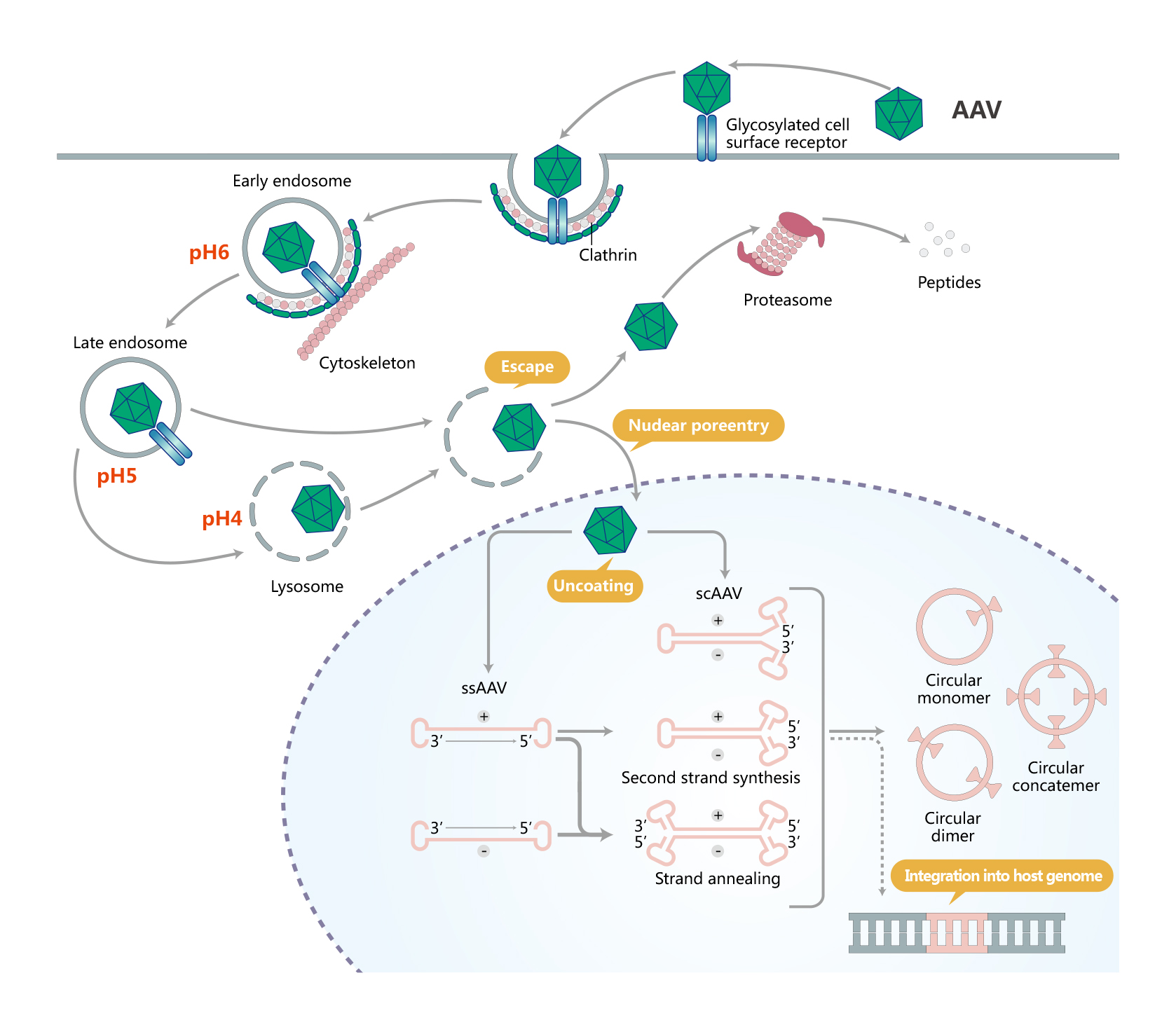
AAV转导细胞主要经历了细胞表面受体介导的内吞、逃离内体、入核、脱衣壳和双链转化几个过程。进入细胞后,可以在辅助病毒的存在下进入其复制周期。
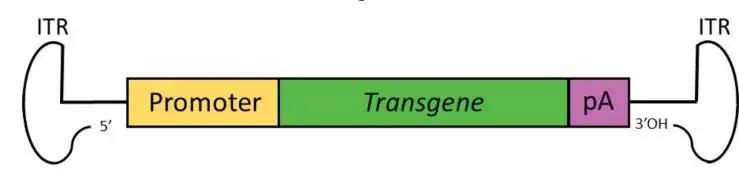
重组AAV载体可以通过将内源性的rep和cap基因替换为一个表达盒,该表达盒由一个启动子驱动一个感兴趣的转基因和一个poly(A)尾巴组成。通过包装质粒反式提供rep和cap基因以及腺病毒辅助质粒来包装载体。病毒编码序列的完全去除使AAV的包装能力最大化(包装容量为4.5Kb),并且有助于它们在体内递送时的低免疫原性和细胞毒性。
基因工程化的AAV能转导外源基因,借助特定启动子、光遗传学/化学遗传学元件、钙指示剂、神经递质探针或Cre/lox P,Flp/FRT重组酶技术,可选择性地标记特定的神经元。重组AAV基因传递效果好、缺乏致病性和安全性高、宿主细胞范围广、在体内表达时间长,是目前最有前途和最成功的基因治疗载体之一。
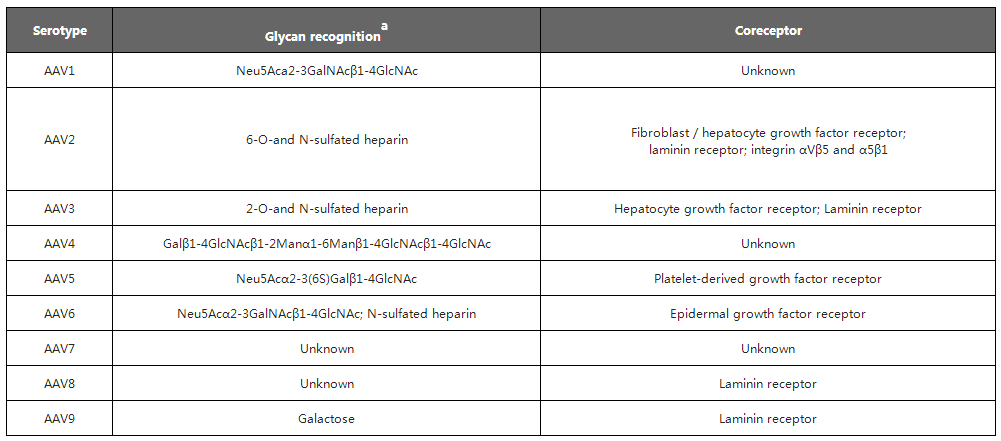
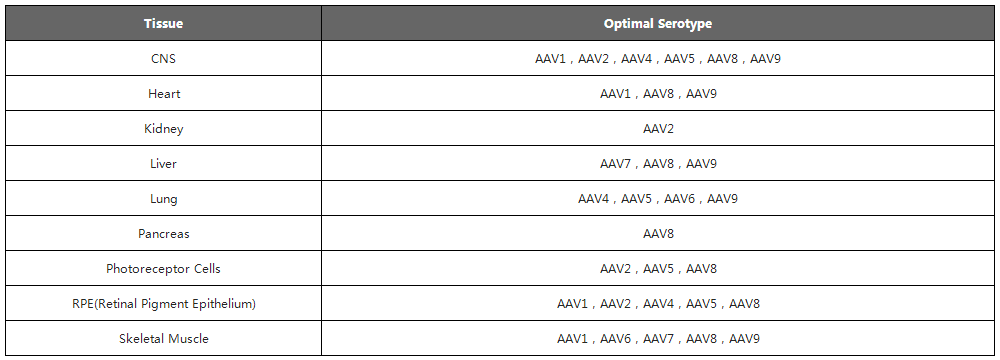
现阶段研究人员已发现12种人类AAV 血清型(AAV1至AAV12)和 100多种非人类灵长动物AAV血清型。不同AAV血清型具有不同的衣壳蛋白空间结构、序列和组织特异性,因而其识别与结合的细胞表面受体也相应有很大差别,这也导致不同血清型转染的组织类型、细胞类型和感染效率也各不相同。
已批准用于商业用途的:AAV1和AAV2;
临床使用频率最高的:AAV2;AAV8,AAV9,AAVRh10;
AAV8,AAV9:靶向全身的多种肌肉类型;
几乎所有天然AAV衣壳都可以在全身给药后有效地转到肝脏;
1. 局部注射,直接在想表达的地方注射 rAAV ,适合器官水平特异感染,容易操作。
2. 使用组织/器官特异启动子来表达外源基因包装 rAAV, rAAV 即使感染了其他组织也由于特异性启动子而不会在其他组织中表达。
3.Cre-on,Flex,DIO,double floxed :使用 Cre-Loxp 系统,经过两次染色体重组在特定脏器中表达外源基因。
目前,研究人员常用的两类AAV分别为single-stranded AAV (ssAAV) and self-complementary AAV (scAAV)。scAAV是基于2个基础被开发的:一个是理论基础:无论scAAV还是rAAV,病毒颗粒中均可包裹二倍体,甚至四倍体的AAV基因组DNA;一个是结构基础:wtAAV ITR序列的特殊性(T型结构)。ssAAV包装基因组正义链和反义链的几率一样。ssAAV在入核、脱衣壳后,需要借助宿主DNA聚合酶或者分子间退火完成双链转化,才能启动基因转录过程,而scAAV中已存在双链,它入核后即可启动基因转录,跨过了双链转化的步骤,从而实现外源基因的快速表达。
ssAAV和scAAV向靶细胞中递送外源基因的过程:

AAV血清型种类众多,其衣壳蛋白氨基酸序列、结构以及它们与宿主细胞因子相互作用的差异性导致不同血清型AAV对不同的组织和细胞感染效率不同,使用AAV作为载体工具时,应选择组织特异性强 的血清型/变体,提高其转导效率。
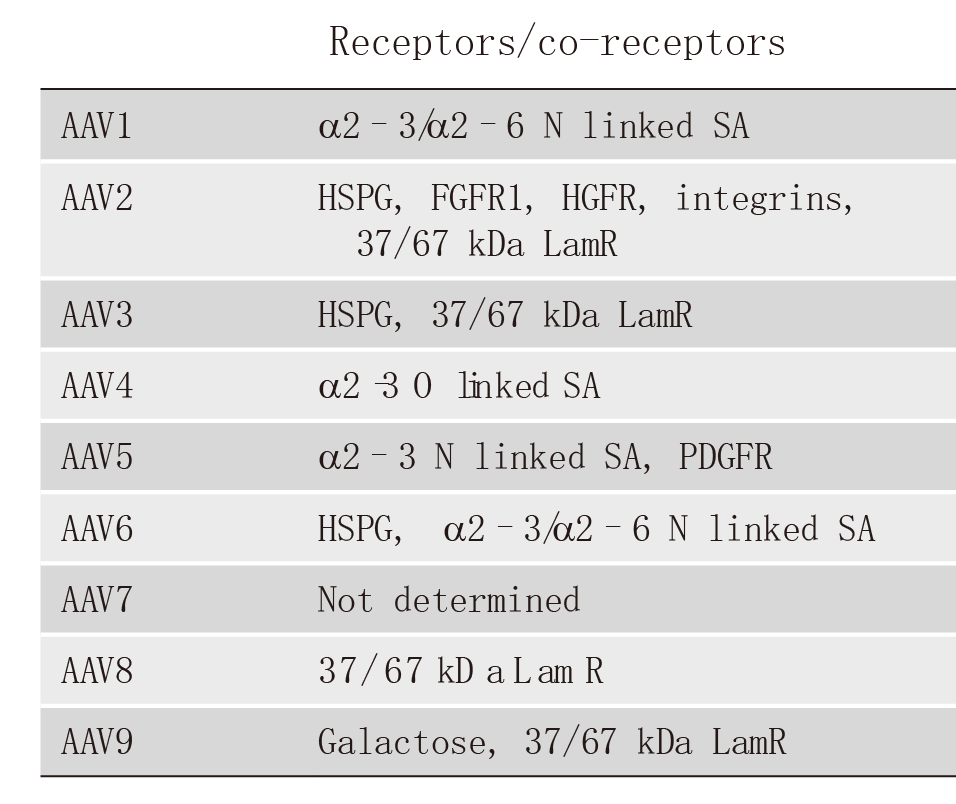
现阶段研究人员已发现12种人类AAV 血清型(AAV1至AAV12)和 100多种非人类灵长动物AAV血清型。下面列举了人类AAV1至AAV9识别的细胞表面受体及不同组织亲嗜性,可根据组织类型选择合适的AAV血清型。在选择血清型时,尽量选择对靶组织和细胞有更高特异性和转导效率的AAV。

在利用AAV进行研究尤其是进行体内实验时,需要将AAV通过不同的方法递送到体内才能发挥作用,AAV注射方式会大大影响AAV介导的转基因的效率,因此,在确定好合适的AAV血清型、启动子等条件后,配以合适的AAV给药方式会取得更好的效果。
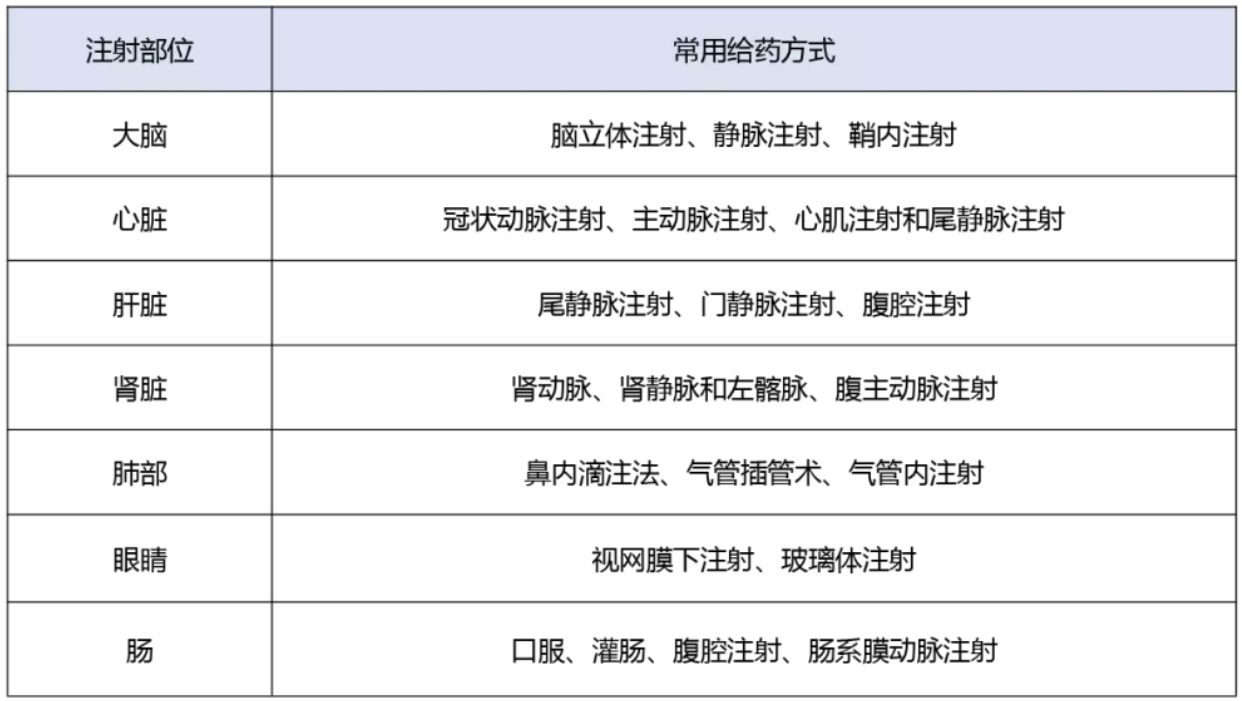
按注射部位,可分为全身给药、局部给药和口服给药。
01全身给药主要分为静脉注射和动脉注射;静脉注射又分为尾静脉注射和门静脉注射等;
02局部给药主要分为肌内注射、肿瘤内注射、脑部注射、玻璃体注射、鼻腔吸入等;
03口服给药,在消化道局部性疾病动物模型中已取得成功,在全身性疾病(糖尿病、贫血等)基因治疗研究同样取得了显著的疗效。然而口服AAV基因药物在基因治疗中仍然面临药物传输上的挑战,如胃肠道中的DNA酶的降解作用、体内体液屏障等。
在具体实验中可以根据不同的注射部位和实验目的选择合适的给药方式,在此,简单归纳了常见注射部位的给药方式供大家参考。
重组腺相关病毒(rAAV)是目前广泛使用的基因转导及基因治疗工具,它可以将DNA分子转导到分裂细胞及终末分化细胞中,并维持基因的相对长效表达。但实际应用时可能会发现目的基因没有表达或者没有达到预想效果,此时,我们可以从以下几个方面来进行分析:
首先,病毒包装制备是否存在问题(比如外源基因是否正确,病毒滴度是否合格等),其次,病毒运输和保存方式是否得当(虽然AAV病毒比较稳定,但仍建议避免反复冻融对病毒滴度带来的不利影响)。
前几期我们已经介绍过,AAV血清型『组织特异性AAV的选择』、启动子『AAV应用之组织特异性启动子的选择』、注射方式『AAV注射方式如何选择?』以及注射量都是影响AAV病毒感染效率的重要因素。如果AAV感染细胞或进行动物注射后没有检测到表达或者表达效果不好,可以综合考虑以上因素进行优化。
通常情况下,AAV在体内表达需要1-2周的时间,表达时间一般能持续半年或更久。如果检测时间过早,可能达不到理想的效果。如果想要实现更快的表达,可以根据基因大小和具体实验需求等选择scAAV,scAAV较ssAAV表达速度更快,且能实现更高水平的表达。
1、目的基因的mRNA和蛋白表达一般通过qRT-PCR和Western Blot方法进行检测。组织的裂解及RNA或蛋白的提取是否充分等因素应该被考虑。
2、如果载体上添加了荧光标签,进行免疫荧光染色分析时,应考虑组织细胞固定的及时性或组织样本切片制备的过程中荧光蛋白的稳定性等因素。在选择检测方法时,我们通常建议采用多种检测方式对病毒和基因表达的情况进行检测。
除以上几种因素外,实验人员的操作手法是否娴熟、选用的实验细胞/动物是否满足实验需求等也是影响实验成功与否的关键因素。此外,建议在正式实验前进行多次预实验以期达到更好的实验效果。