 当前位置:首页 > 专题 > 分子生物学
当前位置:首页 > 专题 > 分子生物学
|
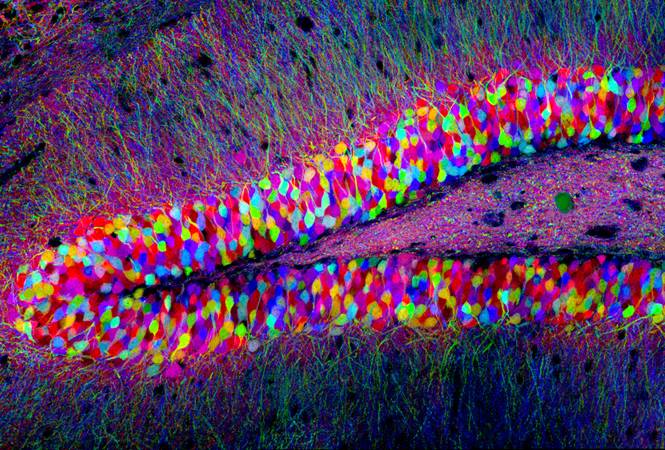
上述如此绚丽多彩的图片是科学家采用2007年哈佛大学脑科学中心开发的Brainbow(彩虹脑)技术对小鼠海马齿状回DG进行多色标记的结果。
Brainbow是一项采用含多色荧光蛋白XFP的重组载体标记大脑的成像技术,其技术精髓就是XFP,技术核心是Cre/Loxp系统。具体来说,在Cre/Loxp系统的删除或(和)颠倒作用下, 由单个启动子在一种细胞群中驱动两到四个XFP随机表达;多个Brainbow转基因拷贝的整合诱发这些XFP的组合表达,从而创造出更多的色彩。在神经系统中,由此产生的多色标记可以用来区分相邻的神经元细胞或胶质细胞,并在追踪神经环路的同时确定神经元突起的身份,从而帮助科学家解析大脑。
那么,作为Brainbow技术精髓的XFP,我们又了解多少呢?本期我们将带领大家深入、全面地了解荧光蛋白。
荧光物质、激发光和荧光
我们在对样品进行荧光成像时,首先样品需要进行荧光标记,其次用某种波长的入射光进行照射,吸收光能后进入激发态,并且立即退激发并发出比入射光波长更长的发射光。在这过程中,用来标记样品并使其具有发光性质的物质叫荧光物质,而照射样品的入射光叫激发光,发出来的发射光就叫荧光。
发光原理
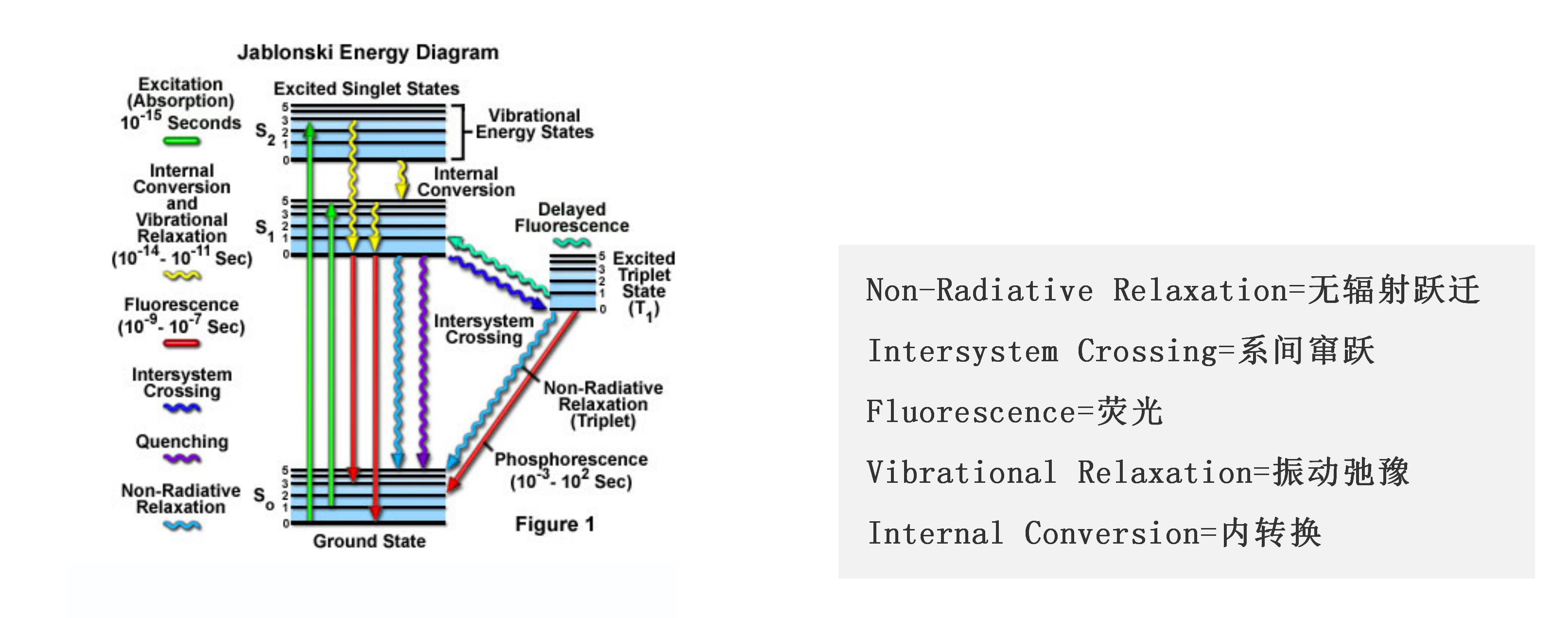
当荧光物质被激发光照射后,激发光的能量就会供给荧光物质,荧光物质吸收能量后发生能级跃迁,即由低能级的基态跃迁至高能级的激发态。而高能级的激发态不稳定,所以会恢复至低能级的基态。在这过程中,荧光物质吸收的能量就会以光的形式进行释放,从而产生荧光。而事实上,在能量释放过程中还有一部分是被丧失掉的,因此发射光的能量低于激发光的能量,相对应地,发射光的波长要比激发光的波长长。荧光物质发光的整个过程可用Jablonski能量图来表示(图1)。
|
荧光光谱
荧光光谱分为激发光谱和发射光谱两种:激发光谱是荧光物质在不同波长的激发光作用下记录的荧光强度随激发光波长的变化情况;而发射光谱则是在固定波长的激发光作用下记录的荧光强度随发射光波长的变化情况。
无论是激发光谱还是发射光谱,记录的均是荧光强调随波长的变化情况,不同的是随谁的波长而变化。电磁波波普将有助于我们了解各波普的波长,从而为我们设计实验提供理论基础(图2)。

|
自1994年GFP首次被用于标记基因后,荧光蛋白(Fluorescent proteins,FPs)就成了生命科学领域中非常重要的细胞成像工具之一。这些FPs借助高分辩率显微技术能够帮助我们观察先前无法看到的生物过程,如活细胞内的代谢过程、信号通路,大脑中的突触链接,癌细胞的扩散等。
荧光蛋白的结构
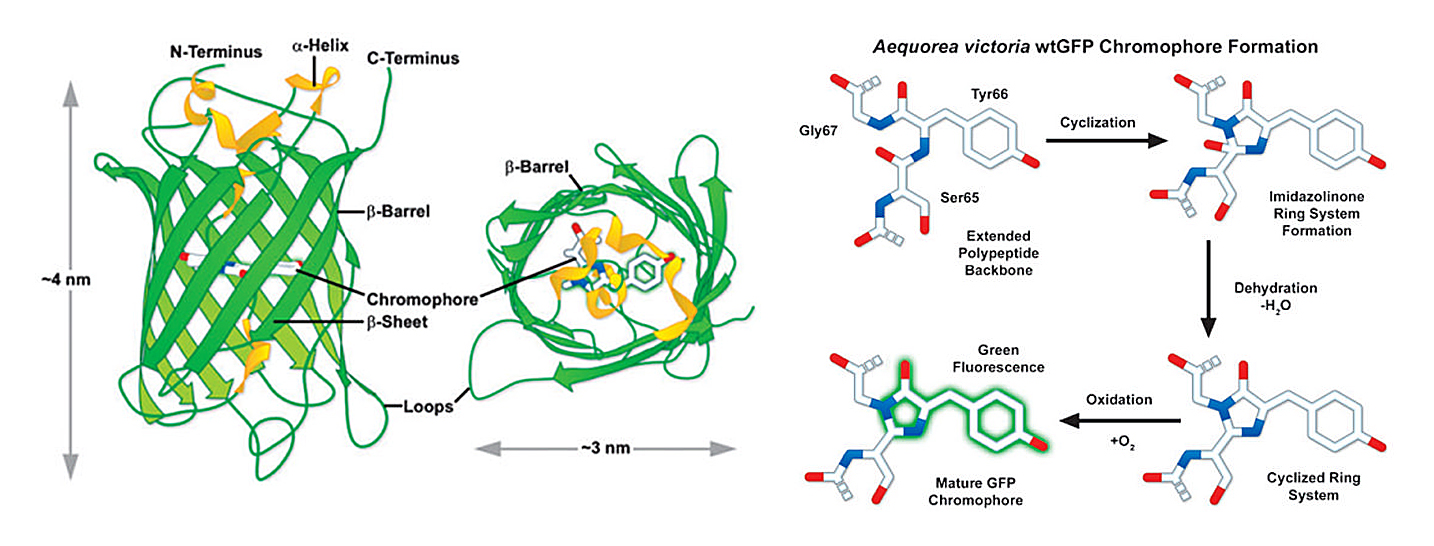
在1996年,GFP的晶体结构被科学家成功解析:GFP是典型的β桶形结构,包括11条β折叠和α螺旋:11条β折叠紧密交织在一起形成圆柱状的“栅栏”,α螺旋上的第65、66、67位氨基酸(丝氨酸、酪氨酸、甘氨酸)位于其正中位置,在分子氧的作用下,经过环化、脱氢等作用最终形成成熟的荧光基团,严密的桶形结构保护着荧光基团,防止它被周围环境淬灭(图3a和3b);N端和C端均暴露在外面。
|
FPs的种类五花八门,就FPbase中收录的就831种,几乎覆盖了从紫外光到远红外光的所有光谱波段。尽管这些FPs的光学特性大相径庭,但是它们的结构却极其相似。结构决定功能,人们对FPs结构的深刻认识对于理解其功能及拓展其范围具有非常重要的理论意义。
合适荧光蛋白的选择指南
面对琳琅满目的FPs,研究人员在具体科学研究中往往受到一系列问题的困扰,如哪些FPs好用?哪些FPs亮度高?哪些因素影响理想FPs的选择?下面我们就从如下几方面一一展开讨论,旨在为大家缩小选择范围提供参考。
①亮度/Brightness
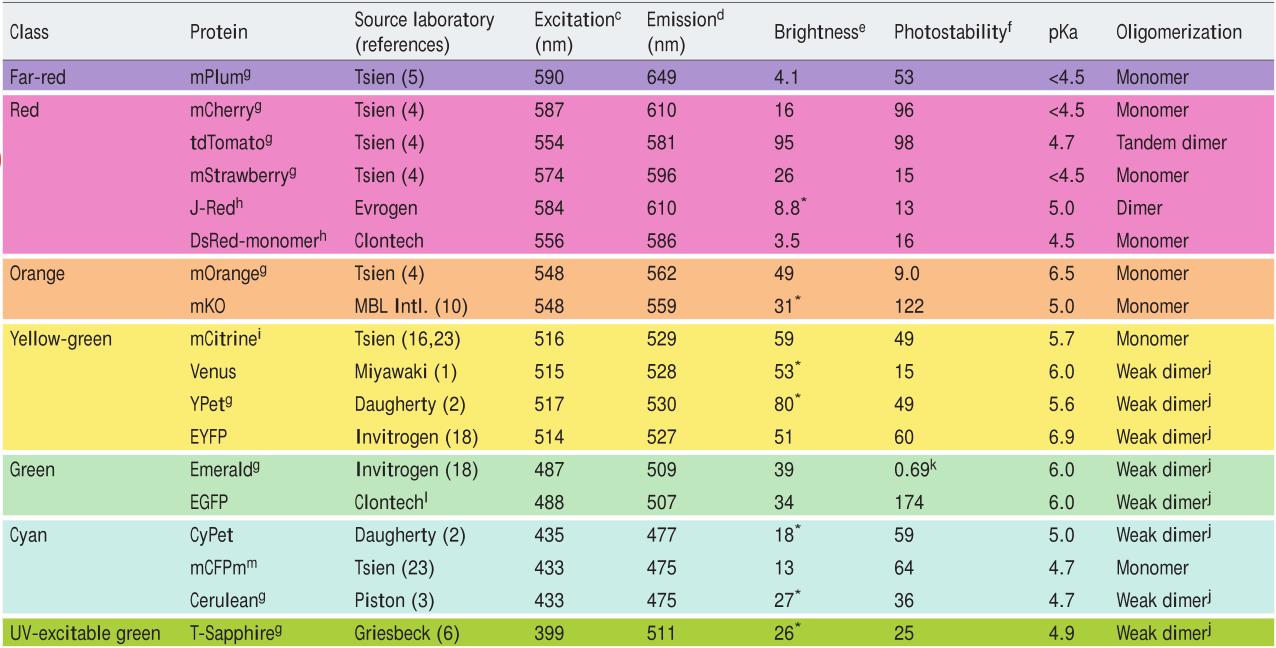
FP的亮度由多种因素决定,包括FP固有的亮度(通常由其成熟速度和效率、消光系数、量子产量和光稳定性[长期实验中]决定)、成像设备的光学特性(照射光的波长和强度,滤光片的光谱和二色镜)和照相机或人眼对发射光谱的敏感性。虽然这些因素无法从整体上鉴定更亮的FP,但是在各个光谱波段内还是有可能鉴定较亮的FP,因为这主要取决于其固有的光学特性。更亮的FP意味着可以用更低的激发光强度进行成像,从而更好地保护样品免受光损伤。而且,更亮的FP可以提供检测和成像所需的足够信号。下表是各光谱波段推荐的FPs(表1)。
|
②表达/Expression
大多数FPs来源于海洋生物,而我们研究的基因大多数来自于哺乳动物。这两种物种的密码子偏好性存在较大差异,这种差异很可能会造成FP在哺乳动物表达系统中低表达甚至不表达,进而观察不到荧光。因此,用于成像实验的FPs往往都需要根据所表达系统进行密码子优化,使其能够很好地表达。庆幸的是,目前我们所使用的FPs已针对哺乳动物的密码子进行了优化,而且可以很好地表达。FPs需要经历转录、翻译、折叠、荧光基团形成等步骤形成成熟蛋白后才能发光。虽然,大多数经过密码子优化的FPs能在哺乳动物系统中很好地表达,但是其折叠效率有快有慢,从而决定了其成熟时间不同。因此,FPs的成熟时间也需考虑在内,在进行目标蛋白亚细胞定位时,我们需要根据其寿命选择相应的FP。
③ 光稳定性/Photostability
所有FPs最终都会在长时间的激发光照射下发生光漂白,从而逐渐丧失发光能力,但是其光漂白速率迥异。因此,针对不同的成像实验,我们需要选择不同光稳定性的FP:对于需要不多于10张图片的短期成像实验,光稳定性通常不是一个主要考虑因素,但在需要大量图片的长期成像实验中,选择极具光稳定性的FP是实验成功的关键。
④聚合性质/Oligomerization
对于蛋白亚细胞定位实验,我们在构建荧光融合蛋白时要选择单体性质的FPs,因为多聚体的FPs很可能会能影响目标蛋白的功能或定位。
⑤环境敏感性/Environmental sensitivity
大多数FPs具有不同程度的酸敏感性,有的适合在酸性环境下使用,有的适合在碱性环境下使用,因此,在不同酸碱度溶液成像中,我们选择FPs时还需考虑其PK 值(用于指示FPs的pH敏感性,PK 值越小酸性越强)。在特定条件下,那些对pH敏感的FPs可以指示细胞内酸碱度的变化,例如单标(GFP-LC3B)和双标(mCherry-GFP-LC3B)自噬指示系统就是利用了GFP和mCherry不同的酸敏感性来追踪自噬流的。
⑥多色标记/Multiple labeling
自GFP被首次用于标记基因后,水母来源的GFP不断被改造,得到了大量蓝色、青色和黄色的衍生物。同时,来自其他物种的FPs也被陆续鉴定,进一步将FPs的颜色拓展至橙色、红色和红外光谱区。从FPs被改造的整个过程,我们可以看出,FPs的改造趋向红移。因为FPs越红越好,颜色越红意味着波长越长,对应的激发光波长也更长,长波长光的激发对细胞和组织的光损伤小,且背景自发荧光和动物组织的光吸收都非常小,组织穿透力强(图4)。这些特征使得红色FPs更适合于体内深组织成像。

|
这些五颜六色的FPs为我们选择FPs进行多色标记实验提供了丰富的资源。值得注意的是,在选择FPs颜色的同时还要兼顾它们的兼容性:一个好的经验法则是,两种FPs的峰激发波长和峰值发射波长均应相隔50-60nm。
⑦设备兼容性/Opitical setup
选择FPs进行成像实验时,所选FPs的光谱范围需满足实验室现有成像设备的需求,毕竟重新购买成像设备成本还是比较高的。推荐使用的成像设备滤光片组合见表2。
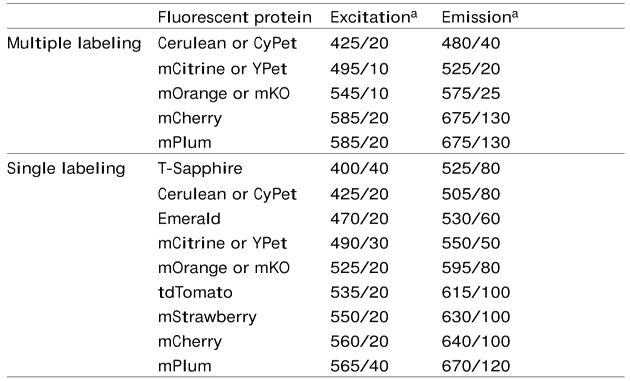
|
荧光蛋白的应用
如今,FPs作为标记蛋白和报告蛋白被广泛应用于生命科学研究的诸多领域,以研究生命系统的组织和功能(图5)。
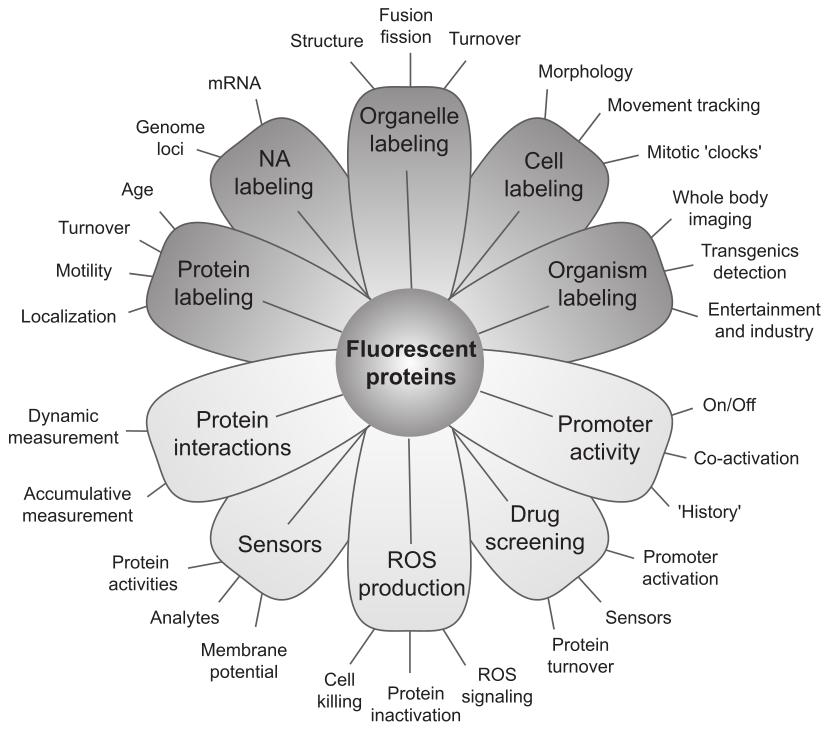
|
①标记蛋白
作为标记蛋白,构建荧光融合蛋白(Fluorescent Fusion Protein, FFP)可以用于研究蛋白定位,追踪其动态变化,追溯其历史和研究蛋白之间的相互作用。那么,如何构建FFP呢?在设计FFP时,我们需要考虑多方面的因素,如FFP的预期用途,选择哪种FP,插入位置等等。随着FPs的发现和发展,很多荧光蛋白载体可通过商业化公司获得。纵观这些载体,FP通常位于多克隆位点附近(即目标蛋白的N端或C端,图6)。在根据上述FP选择指南选定载体后,我们仅需通过简单的亚克隆技术将目标蛋白克隆至多克隆位点区即可。当FP位于目标蛋白C端时,为了确保两者的正确折叠和功能,一段由2-10个氨基酸组成的链接序列(GS间隔,linker)往往是有用的。
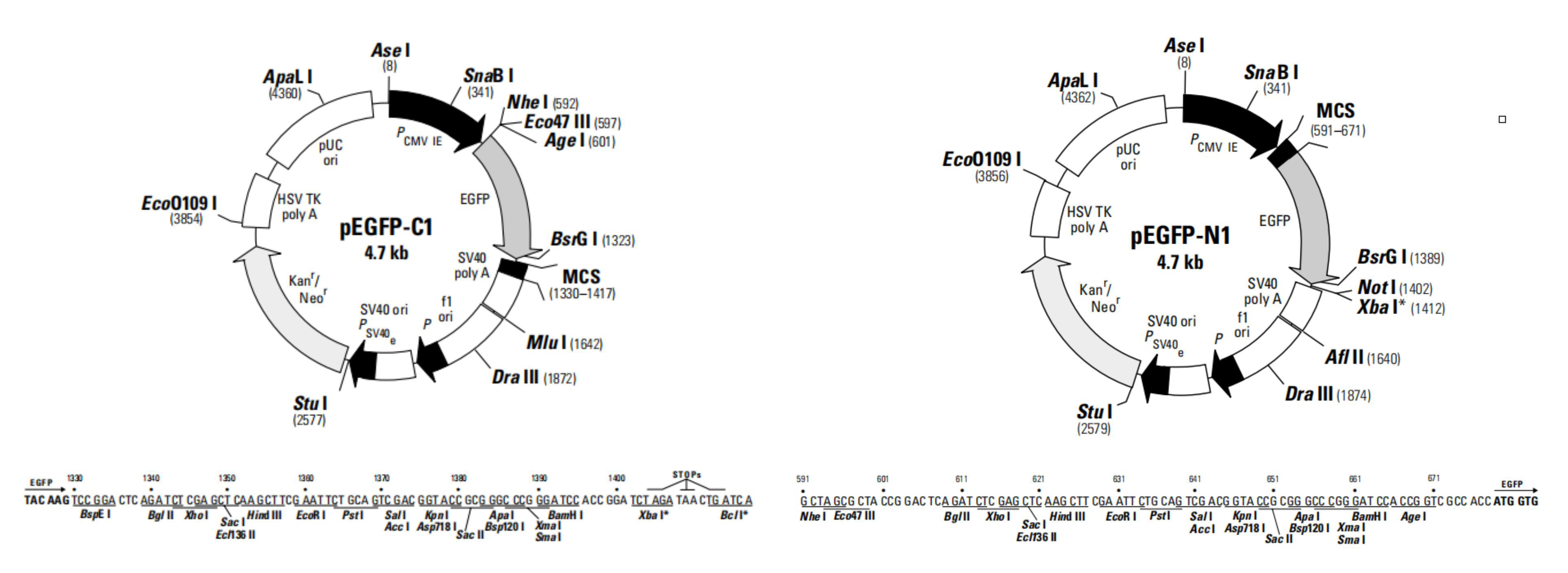
|
但是,在许多情况下,我们需要根据目标蛋白的实际情况修饰FFP,如内质网蛋白和膜蛋白:一个典型的内质网蛋白通常含有两段关键序列(信号序列,SS;内质网滞留序列,KDEL),若其功能域靠近C端,FP应置于SS下游2-10个氨基酸处,这样可以提高SS的切割效率,并有利于FFP的内质网易位;若其功能域靠近N端,FP应插入KDEL之前;对于单次跨膜蛋白,FP不能置于跨膜结构域(TMD)内/附近,因为这将破坏结构域并导致膜整合的问题;对于多次跨膜蛋白,除了单次跨膜蛋白的不适位置外,FP也不可置于TMDs之间的环内,因为TMDs之间的精确间距对于其正确折叠非常重要,且这些环通常包含功能域(图7)。另外,还有些目标蛋白在成熟过程中会切掉一段,如自噬标志物LC3。
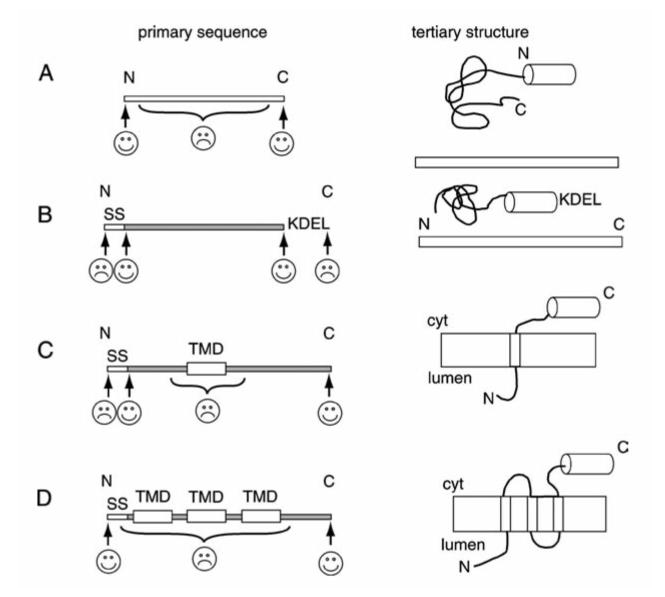
|
总之,不管如何构建FFP,我们均需要确保FFP的序列正确,并通过实验确认其是否发光,其定位模式是否与目标蛋白的类似,是否保留有目标蛋白的功能等等。
②报告蛋白
作为报告蛋白,FPs借助极具市场前景的AAV病毒载体被广泛应用于神经科学研究的各个阶段,包括神经标记,基因操作,生理操纵和生理观察。下面我们仅列举几个例子说明:
案例1:FPs用于标记全脑和局部脑区的神经细胞(图8)

|

|
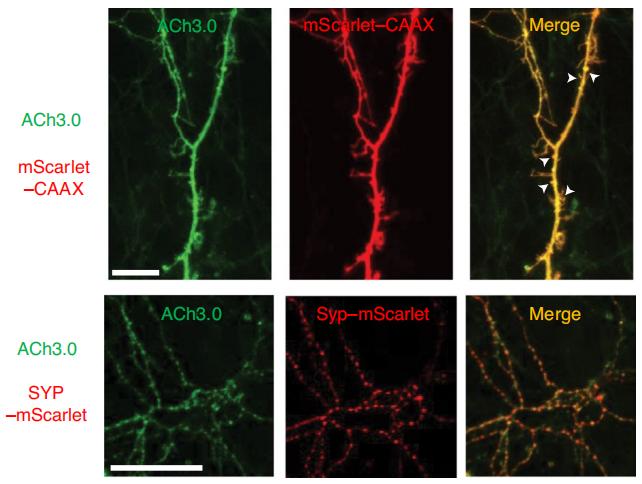
|
随着技术的进步,越来越多的FPs被开发并应用。因此,科研人对于FPs可以说是众所周知。尽管目前已有的FPs为科研人的各种成像实验带来了众多选择。但是,随着研究的深入,科研人对于成像实验提出了更高的需求,尤其在神经网络纵横交错的神经系统中体现地淋漓尽致。未来,亮度高、稳定性高的单体FPs将可以进行更密集的成像实验;高效折叠的单体光转换FPs将提高我们光标记融合蛋白的能力,FPs光谱的长波长端将继续拓宽,使科研人能够在深组织和整个动物中进行更灵敏、更高效的成像实验。
参考文献:
1、Day, R. N. and M. W. Davidson (2009). "The fluorescent protein palette: tools for cellular imaging." Chem Soc Rev 38(10): 2887-2921.
2、2、Shaner, N. C., et al. (2005). "A guide to choosing fluorescent proteins." Nat Methods 2(12): 905-909.
3、Keereweer, S., et al. (2013). "Optical image-guided cancer surgery: challenges and limitations." Clin Cancer Res 19(14): 3745-3754.
4、Chudakov, D. M., et al. (2010). "Fluorescent proteins and their applications in imaging living cells and tissues." Physiol Rev 90(3): 1103-1163.
5、Mathiesen, S. N., et al. (2020). "CNS Transduction Benefits of AAV-PHP.eB over AAV9 Are Dependent on Administration Route and Mouse Strain." Mol Ther Methods Clin Dev 19: 447-458.
6、Jing, M., et al. (2020). "An optimized acetylcholine sensor for monitoring in vivo cholinergic activity." Nat Methods 17(11): 1139-1146.